
题目列表(包括答案和解析)
21.(10分)对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系。
若25℃时有HA H++A-,则K==
H++A-,则K==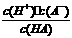
式中:K为电离平衡常数,只与温度有关,c为各微粒的平衡浓度。下表是几种常见弱酸的电离平衡常数(25℃)。
|
酸 |
电离方程式 |
电离平衡常数K |
|
CH3COOH |
CH3COOH CH3COO-+H+ CH3COO-+H+ |
1.76×10-5 |
|
H2CO3 |
H2CO3 H++HCO3- H++HCO3-HCO3-  H++CO32- H++CO32- |
K1==4.31×10-7 K2==5.61×10-11 |
|
H2S |
H2S H++HS- H++HS-HS-  H++S2- H++S2- |
K1==9.1×10-8 K2==1.1×10-12 |
|
H3PO4 |
H3PO4 H++H2PO4- H++H2PO4-H2PO4-  H++HPO42- H++HPO42-HPO42- 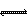 H++PO43- H++PO43- |
K1==7.52×10-3 K2==6.23×10-8 K3==2.20×10-13 |
回答下列各题:
(1)K只与温度有关,当温度升高时,K值__________(填“增大”、“减小”、“不变”)。
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱有何关 系?_____________________________。
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看作是酸,其中酸性最强的是__________,最弱的是_____________。
(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数,对于同一种多元弱酸的K1、K2、K3之间存在着数量上的规律,此规律是________________,产生此规律的原因是___________________________________。
20. (10分)下图是中学化学中一些常见的物质之间发生的一系列转化的框图(反应所需和所产生的水及某些反应条件已略),其中A、B、F、Y为黑色的固体,E、G在常温常压下是气体。
(10分)下图是中学化学中一些常见的物质之间发生的一系列转化的框图(反应所需和所产生的水及某些反应条件已略),其中A、B、F、Y为黑色的固体,E、G在常温常压下是气体。
(1)写出下列物质的化学式:D____________,E____________。
(2)写出G通入I溶液发生反应⑦的离子方程式___________________________。
(3)以惰性电极电解X溶液的离子方程式_________________________________。
(4)试根据B、Y与氧气反应过程中的量的变化关系,设计一个实验,不用实验室里的任何试剂,只用常用的仪器,区分B、Y两种物质(简要说明实验方法和实验结论)
__________________________________________________________________________。
19.(8分)(1)若AgC1在水中、0.01 mol·L-1 CaCl2溶液中、0.01 mol·L-1 NaCl溶液中及0.05 mol·L-1AgNO3溶液中的溶解度分别为S1、S2、S3、S4,则S1、S2、S3、S4由大到小的顺序为 。
(2)下列曲线分别表示元素的某种性质与核电荷的关系(Z为核电荷数,Y为元素的有关
性质)。把与下面元素有关的性质相符的曲线标号填入相应的空格中:
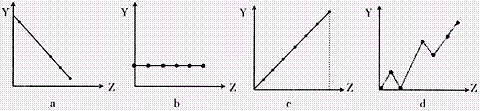
①ⅡA族元素的价电子数 ;②第3周期元素的最高化合价 ;
(3)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3:4;M元素原子的最外层电子数与电子层数之比为4:3;N-、Z+、X+离子的半径逐渐减小;化合物XN常温下为气体。据此回答:
①N的最高价氧化物的水化物的化学式为 。
②化合物A、B均为由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比均为1:1:1,A溶液中水的电离程度比B溶液中水的电离程度小。则化合物A中的化学键类型为 ,B的化学式为 。
③工业上制取单质M的化学方程式为 。
18.(12分)某化学兴趣小组参考工业制硝酸的化学原理,在实验室用下列各装置进行组合来制备硝酸并验证硝酸的性质(所给装置必须用到并且只能用一次,各装置中的试剂均足量。已知常温下CaCl2能吸收氨气)。
 (1)装置的连接顺序为(用a、b、c、d等字母表示):b接( ),( )接( ),( )接( )。
(1)装置的连接顺序为(用a、b、c、d等字母表示):b接( ),( )接( ),( )接( )。
(2)写出氨气催化氧化的化学方程式______________________。
(3)进行实验时,装置A中碱石灰的作用是_________;D中的现象是__________________。
(4)能证明有硝酸生成的现象是__________________________________________。
(5)实验开始时,下列操作顺序最合理的是______________。
a.先加热A装置中的催化剂.再由导管a通入空气
b.先由导管a通入空气,再加热A装置中的催化剂
c.在由导管a通入空气的同时,加热A装置中的催化剂
17.(10分)Na2O2与水的反应实际是Na2O2 + 2H2O === 2NaOH + H2O2,反应放热,反应放出的热量使部分H2O2受热分解:2H2O2===2H2O +O2↑。为了测定某过氧化钠固体的纯度,今做如下实验:①称取过氧化钠固体2.00g;②把这些过氧化钠固体放入气密性良好的气体发生装置中;③向过氧化钠中滴加水,用某一量筒排水集气,量筒内液面在110mL处恰好与水槽内液面相平;④将烧瓶中的液体转移到250mL的容量瓶中,然后加入蒸馏水,定容,使液面恰好与刻度相切;⑤用移液管移取25.00mL容量瓶中的液体,放入锥形瓶中,用过量的稀硫酸酸化,然后用0.01mol/L的KMnO4溶液去滴定,至终点时用去了24.20 mLKMnO4溶液(此时锰全部以Mn2+存在)
(1)有500ml、250ml、150ml的量筒备用,应选用量程为 的量筒,理由是
;
(2)有酸式和碱式两种滴定管备用,该实验应选用 ,理由是 ;
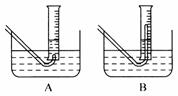 (3)在步骤③测量气体体积时,必须待试管和量筒内的气体都
(3)在步骤③测量气体体积时,必须待试管和量筒内的气体都
冷却到室温时进行,应选用下图装置中 ,理由是 ;此时量筒内的液面高于水槽中液面,立即读数会使Na2O2的纯度 (填“偏高”“偏低”或“不变”);应进行的操作是 ;
(4)在步骤⑤中滴定达到终点时,溶液的颜色变化是 ;
(5)该过氧化钠的纯度为 (实验中得到的气体体积均看作为标准状况下)。
16.常温下,0.1 mol·L-1某一元酸(HA)溶液中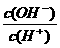 =1×10-8,下列叙述正确的是
=1×10-8,下列叙述正确的是
A.该溶液中由水电离出的c(H+)=1×10-11 mol·L-1
B.浓度均为0.1mol/L的HA和NaA溶液等体积混合后,若溶液呈酸性,
则c(A-)>c(HA)>c(Na+)>c(H+)>c(OH-)
C.0.1 mol·L-1HA溶液与0.05 mol·L-1 NaOH溶液等体积混合后所得溶液中
c(A-) + c(HA) = c(Na+)
D.0.1 mol·L-1HA溶液与0.05 mol·L-1 NaOH溶液等体积混合后所得溶液中
2c(H+)+ c(HA) = c(A-) + 2c(OH-)
第Ⅱ卷(非选择题 共86分)
15.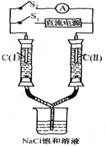 如右图所示装置,两玻璃管中盛满滴有酚酞溶液的NaCl饱和溶液, C(Ⅰ)、c(Ⅱ)为多孔石墨电极。断开S2接通S1后,c(I)附近溶液变红,两玻璃管中有气体生成。一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转.说明此时该装置形成了原电池。关于该原电池的叙述正确的是
如右图所示装置,两玻璃管中盛满滴有酚酞溶液的NaCl饱和溶液, C(Ⅰ)、c(Ⅱ)为多孔石墨电极。断开S2接通S1后,c(I)附近溶液变红,两玻璃管中有气体生成。一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转.说明此时该装置形成了原电池。关于该原电池的叙述正确的是
A.C(I)的电极名称是负极
B.C(Ⅱ)的电极名称是阳极
C.C(I)的电极反应式是2H++2e一=H2↑
D.C(Ⅱ)的电极反应式是Cl2 +2e一=2Cl一
14.某化学兴趣小组用回收的镁铝合金制取氢气。现有l0.8 g镁铝合金,下列说法正确的是
A.常温下与足量18mol/LH2SO4溶液反应,最多可放出0.6 mol H2
B.常温下与足量2mol/LHNO3溶液反应,最少可放出0.45 mol H2
C.常温下与足量2 mol/L H2SO4溶液反应,放出H2的物质的量在0.45 -0.6 mol之间
D.常温下与足量2mol/LNaOH溶液反应,放出H2的物质的量在0.45 -0.6 mol之间
13.已知:SO32一+I2+H2O=SO42一+2H++2I一,某溶液中可能含有I一、 NH4+、Cu2+、SO32一,向该无色溶液中加人少量溴水,溶液仍呈无色,则下列关于泼溶液组成的判断正确的是
A.肯定不含I一 B.肯定不含Cu2+
C.可能含有SO32一 D.可能含有I一
12.某无色溶液,由Na+、Ba2+、Al3+、AlO2-、Fe3+、CO32-、SO42-中的若干种组成。取适量该溶液进行如下实验:① 加入过量盐酸,有气体生成;② 在①所得的溶液中再加入过量碳酸氢铵溶液,有气体生成,同时析出白色沉淀甲;③ 在②所得溶液中加入过量Ba(OH)2溶液,也有气体生成,并有白色沉淀乙析出。原溶液中一定存在的离子是
A.Al3+、Fe3+、SO42- B.Na+、AlO2-、CO32-
C.Na+、AlO2-、SO42-、CO32- D.Na+、Ba2+、AlO2-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com