
题目列表(包括答案和解析)
6、A、B都是短周期元素,原子半径B>A,它们可以形成化合物AB2,则下列结论正确的是( )
A.A、B可能在同一周期; B.A、B的单质都不可能是原子晶体
C.A肯定是金属元素; D.A可能在第二周期的ⅡA或ⅣA
25.(10分)水银法电解食盐水是氯碱工业发展进程中的重要里程碑,以制得碱液纯度高、质量好著称,其生产原理示意如下:
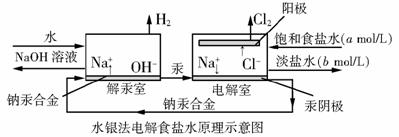
⑴分别写出电解池、解汞室中发生反应的离子方程式。
⑵当阳极产生3.36m3(标准状况)Cl2时,解汞室中生成NaOH的质量为多少千克。
⑶电解室中NaCl溶液的流入、流出速率均为VL/min,若生产上要求流出碱液的物质的量浓度为cmol/L,计算解汞室中碱液的流出速率Q(单位:L/min)。
⑷20世纪60年代,氯碱生产采用离子膜法,水银法逐渐被淘汰,你认为被淘汰的主要原因是什么?
24.(8分)某结晶水合物含有两种阳离子和一种阴离子。现称取10.00g的该结晶水合物,配制溶液。向其中加入足量的稀Ba(OH)2溶液,有浅蓝色沉淀生成;加热该混合物,逸出能使湿润的红色石蕊试纸变蓝的气体;将所得气体用100.0mL0.5000mol/L硫酸吸收,多余的硫酸用2.000mol/LNaOH溶液滴定,用去NaOH溶液25.00mL。用盐酸处理上述浅蓝色沉淀,经洗涤和干燥,得到白色固体11.65g。
⑴该结晶水合物中含有的两种阳离子是 和 ,阴离子是 。
⑵试通过计算确定该结晶水合物的化学式。
23.(10分)有机物F商品名称“敌稗(Propanil)”,是一种优良的水稻除草剂,现通过下列合成路线制备:
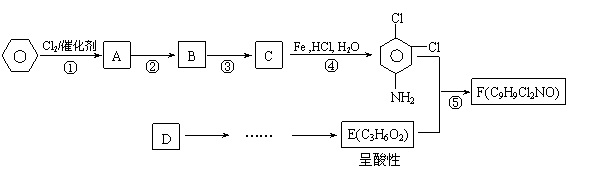
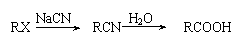 已知:
已知:
Ⅰ. (X表示卤素原子,下同)
Ⅱ.
Ⅲ.当一取代苯继续发生取代反应时,新引进的取代基受到原取代基的影响而取代邻位、对位或间位。使新的取代基进入它的邻位、对位的取代基:-CH3、-NH2、-X;使新的取代基进入它的间位的取代基有:-COOH、-NO2等。
请结合上述所给信息,回答问题:
⑴反应②条件 。
⑵有人认为:若将②、③两步反应顺序颠倒,也可以得到C,实际上是不妥的。请你指出不妥之处 。
⑶反应⑤的化学反应方程式: 。
⑷请你设计D→E(C3H6O2)的合成路线。
要求:
①合成过程中无机试剂任选、有机原料碳原子不超过2个;②合成反应流程图表示方法示例如下:
22.(8分)胡椒酚A是植物挥发油中的一种成分。某研究性学习小组对其分子组成结构的研究中发现:A的相对分子质量不超过150;A中C、O的质量分数分别为:w(C)=80.60%,w(O)=11.94%,完全燃烧后产物只有CO2和H2O。
根据以上信息,填写下列内容:
⑴A的摩尔质量为 。
⑵光谱分析发现A中不含甲基(-CH3),苯环上的一氯取代只有2种;1molA与足量溴水反应,最多消耗3molBr2。A的结构简式为 。
⑶A的一种同分异构体中,苯环上含有两个取代基,取代基位置与A相同,且能发生银镜反应。
①符合条件的A的同分异构体的结构简式 。
②上述A的一种同分异构体发生银镜反应的化学方程式 。
21.(10分)随着经济的发展和人民生活水平的提高,近年来我省汽车拥有量呈较快增长趋势。
⑴乙丙橡胶(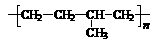 )因柔韧性好而被用于制造汽车门窗密封胶条,工业生产乙丙橡胶的单体是
。
)因柔韧性好而被用于制造汽车门窗密封胶条,工业生产乙丙橡胶的单体是
。
 ⑵金属防护对汽车工业具有重要意义。铝的阳极氧化是一种常用的金属表面处理技术,它能使铝的表面生成一层致密的氧化铝薄膜,该氧化膜不溶于电解时使用的电解液--稀硫酸。写出该过程阳极反应的电极反应式
。
⑵金属防护对汽车工业具有重要意义。铝的阳极氧化是一种常用的金属表面处理技术,它能使铝的表面生成一层致密的氧化铝薄膜,该氧化膜不溶于电解时使用的电解液--稀硫酸。写出该过程阳极反应的电极反应式
。
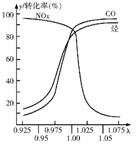
⑶在发动机和三元催化转化器间的尾气流中安装一个称为λ探测器的电化学元件,可测定λ(λ=入口处的空气量/完全燃烧需要的空气量)值,如右图所示。当汽车速度增加时,入口处的空气量增大,此时排出尾气中的主要污染物是 。在转化器的前半部,一氧化碳和氮氧化物(NOx)通过催化剂发生反应转化为无污染的气体,其反应的化学方程式为 。为了降低汽车尾气对大气的污染,有关部门拟用甲醇替代作为公交车的燃料。已知:甲醇燃烧热为726kJ/mol。请写出甲醇燃烧的热化学方程式 。
20.(10分)已知:A为常见金属,B是一种盐,C中A元素的质量分数为25.3%,K是一种重要的矿石,D、E、G、H常温下均为气体,L是红褐色固体。②、③、⑤均为工业生产中的重要反应。各物质间的相互转化关系如下图:(其中某些反应的部分生成物被略去)
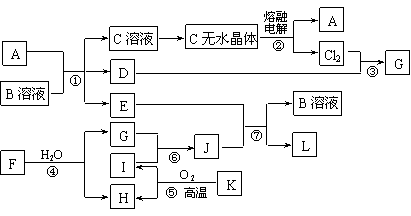
请按要求填空:
⑴工业生产中,实现反应⑤的设备是 。
⑵由“C溶液→C的无水晶体”需特定的气体氛围,该气体是上述转化关系中的 (填“字母”)。
⑶反应①的离子方程式为 ;
将J滴入沸水中的离子方程式为 。
⑷若反应④表示为“F+H2O=2G+H”,则可推知F的化学式___ __。
19.(10分)科学家发现在特殊条件下,水能表现出许多有趣的结构和性质。
⑴一定条件下给水施加一个弱电场,常温常压下水结成冰,俗称“热冰”,其计算机模拟图如下。

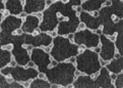

水 热冰
使水结成“热冰”采用“弱电场”的条件,说明水分子是 分子。请你展开想象,给“热冰”设计一个应用实例 。
⑵用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种阳离子。
①释放出来的电子可以被若干水分子形成的“网”捕获而形成水合电子,你认为水分子间能形成“网”的原因是 。
②由水分子释放出电子时产生的一种阳离子具有较强的氧化性,试写出该阳离子与SO2的水溶液反应的离子方程式 ;该阳离子还能与水分子作用生成羟基,经测定此时的水具有酸性,写出该过程的离子方程式 。
18.(12分)纳米材料在绝大多数同学眼里都非常神秘。某化学学习小组决定通过查阅有关资料,自己动手实验,制备纳米铁粉。
[实验原理]
⑴用硫酸亚铁、草酸两溶液制备草酸亚铁晶体(溶解度较小)。该反应的化学方程式是
。
⑵焙烧草酸亚铁晶体:FeC2O4·2H2O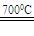 Fe+2CO2↑+2H2O↑
Fe+2CO2↑+2H2O↑
[操作步骤]
⑴草酸亚铁晶体的制备

①现有烧杯、玻璃棒、药匙、滤纸、托盘天平、FeSO4、草酸等实验用品,为配制上述两溶液,缺少的仪器有 。
②若配制的FeSO4溶液略呈黄色,可能的原因是 。
③检验草酸亚铁晶体是否洗净的方法是 。
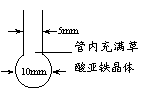 ⑵纳米铁粉的制备
⑵纳米铁粉的制备
将一根长度约为12 cm-14cm的玻璃管在酒精喷灯上烧制成如图所示形状,向其中加入黄色草酸亚铁晶体。再将管口部分加热拉细,然后在酒精喷灯上均匀加热。当草酸亚铁粉末受热完全变黑,立即将管口拉细的部分放在火焰烧熔封闭,这样便得到了高纯度的纳米铁粉。
①实验中分解产生CO2所起的作用是 。
②指导老师提醒同学们应准确把握玻璃管的烧熔封闭时间。你认为烧熔过早、过晚的后果是 。
17.(8分)某化学兴趣小组利用饱和氯水与石灰石的反应,制取较浓的HClO溶液,并对所得溶液中的部分阴离子进行检验。
|
|
实验操作 |
实验现象 |
|
步骤1 |
在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,过滤,将滤液分为若干份 |
有少量气泡产生,溶液的黄绿色褪去 |
|
步骤2 |
将第一份滤液与稀盐酸混合 |
产生大量气泡 |
|
步骤3 |
将第二份滤液加热 |
溶液变浑浊,且有大量无色气体产生 |
⑴步骤1过滤的目的是__________________________________________。
⑵步骤2、步骤3的实验目的都是 ;为达到该实验目的,还可以采取的方法是 。
⑶请你设计一个简单的实验方案,证明步骤1所得滤液中的HClO浓度比饱和氯水中HClO浓度大: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com