
题目列表(包括答案和解析)
28、(14分)
甲、乙、丙三位同学按下列方法制取氢氧化铝,请你参与并回答有关问题。
甲:用可溶性铝盐与稀氨水反应制取氢氧化铝。写出该反应的离子方程式:
 ▲ 。
▲ 。
乙:根据右图电解装置制取氢氧化铝。请回答:
⑴ 电源中A极是 ▲ 极,铝极的电极反应式为 ▲ ;
⑵ 从原理分析,电解质NaCl的作用是 ▲ 。
丙:利用铝屑、稀H2SO4、NaOH溶液为主要原料制取Al(OH)3固体。
⑴ 先设计了如下三种方案:
Ⅰ Al3+→Al(OH)3
Ⅱ Al→AlO2-→Al(OH)3
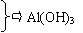 Ⅲ Al→ Al2(SO4)3
Ⅲ Al→ Al2(SO4)3
Al → NaAlO2
从节省原料的角度分析,你认为最合理的方案是 ▲ 。
⑵设计了如下实验步骤:
①配制500 ml0.5 mol•L-1NaOH溶液所用到的仪器有:托盘天平、烧杯、玻璃棒、
▲ ;
②在烧杯A中加入50 ml0.5 mol•L-1NaOH溶液,再加入足量铝屑给溶液稍加热。其作用是 ▲ ,用蒸馏水把铝屑冲洗干净称其质量为m1g(全部用于制氢氧化铝);
③在盛有适量稀H2SO4的烧杯B中放入 ▲ g(含m1的式子表示)铝屑,充分搅拌使铝屑反应完全;
④在盛有适量浓NaOH溶液的烧杯C中入一定质量的铝屑,充分搅拌使铝屑反应完全。该反应的化学方程式为 ▲ ;
⑤将烧杯B和烧杯C中的溶液混合,得到氢氧化铝白色沉淀;
⑥将沉淀过滤、洗涤、干燥得Al(OH)3固体m2g。
试计算此实验中Al(OH)3的产率是 ▲ 。
27、(16分)甲、乙、丙均为中学化学常见的气体单质,A、B、C 均为常见的化合物。
已知:①甲、乙生成A是工业生产中常见的反应之一;
②甲与乙在一定条件下反应的有关数据为:
|
物质 |
甲 |
乙 |
A |
|
起始时浓度 |
3 mol•L-1 |
3 mol•L-1 |
0 |
|
2 s 末浓度 |
1.8 mol•L-1 |
2.6 mol•L-1 |
0.8 mol•L-1 |
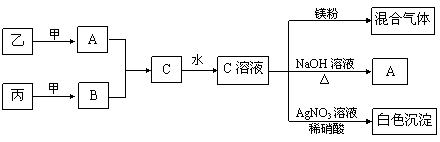 ③ 它们之间存在如下图所示的转化关系:
③ 它们之间存在如下图所示的转化关系:
根据上述信息,回答下列问题:
⑴ 乙的电子式为 ▲ ;
⑵ C晶体中所含的化学键有 ▲ ;
⑶
甲与乙反应的化学方程式为 ▲ ,在前2 s 内甲与乙反应的平均速率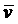 (甲)=
(甲)=
▲ ,2 s末乙的转化率为 ▲ ;
⑷常温下,1g甲在丙中燃烧生成气态B,放出92.3KJ热量,写出该反应的热化学方程式:
▲ ;
⑸ C溶液与镁粉反应生成混合气体的化学式可能为 ▲ ,试分析产生混合气体珠原因 ▲ 。
26、(12分)
铁及其化合物的应用十分广泛,亚铁盐、铁盐、高铁酸盐(高铁酸盐只能在强碱性介质中稳定存在)等铁的化合物也在不同的领域中各扮演着重要角色,可用下式表示它们之间的相互转化:
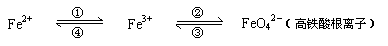
回答下列有关问题:
⑴ Fe与稀硫酸反应可以制取FeSO4,
写出此反应的化学方程式 ▲ ,在此反应中,氧化产物是 ▲ ;
⑵ 用上述⑴反应所得的酸性溶液,实现上述①、④的转化,要求产物纯净:
要实现①转化可选用的试剂是 ▲ ,
A、Cl2 B、H2O2 C、O3 D、KMnO4
要实现④转化,写出反应的离子方程式 ▲ ;
⑶ 在强碱性溶液中,用NaClO可实现②转化,若生成1mol FeO42-,则需NaClO ▲ mol;
高铁酸盐是一种“绿色环保高效”消毒剂,比含氯消毒剂的性能更为优良。使用高铁酸盐消毒剂,不仅可以消毒杀菌,还能净水,消毒杀菌时发生的转化是③,净水时发生反应的离子方程式为 ▲ 。
13、向某二价金属M的M(OH)2的溶液中加入过量的NaHCO3溶液,生成了MCO3沉淀,过滤,将沉淀置于足量的稀盐酸中,充分反应后,在标准状况下收集到V L气体。如要计算金属M的相对原子质量,你认为还必需提供下列哪项数据 ( )
A.M(OH)2溶液的物质的量浓度 B.与MCO3反应的盐酸的物质的量浓度
C.MCO3的质量 D.题给条件充足,不需要在补充数据
12、 已知反应2SO2(g)+O2(g) 2SO3(g);△H<0。现有甲、乙两个容积相同的恒容容器。在500℃和有催化剂存在下,向甲中加入2molSO2和1molO2,向乙中加入2molSO3,并同时发生反应。当两容器中反应分别达到平衡后,维持条件不变,则
已知反应2SO2(g)+O2(g) 2SO3(g);△H<0。现有甲、乙两个容积相同的恒容容器。在500℃和有催化剂存在下,向甲中加入2molSO2和1molO2,向乙中加入2molSO3,并同时发生反应。当两容器中反应分别达到平衡后,维持条件不变,则
①平衡时甲中SO2的转化率一定等于乙中SO3的分解率
②从开始反应到平衡,甲中反应放出的热量与乙中反应吸收的热量一定相等
③平衡时,甲、乙两容器中混合气体平均相对分子质量一定相等
④从反应开始到刚好建立平衡时所用的时间甲一定等于乙
以上说法中正确的是 ( )
A.③ B.①② C.③④ D.①②③
11、下列说法正确的是 ( )
A.常温下醋酸分子不可能存在于pH>7的碱性溶液中
B.常温下向氯化铵溶液中加入少量氨水使溶液的pH=7,则混合溶液中c(NH4+)=c(Cl-)
C.0.1 mol•L-1的氯化铵溶液与0.05 mol•L-1的氢氧化钠溶液等体积混合后,混合溶液中离子浓度c(Cl-)>c(Na+)>c(NH4+)>c(OH-)
D.0.1 mol•L-1硫化钠溶液中离子浓度关系c(Na+)=c(S2-)+c(HS-)+c(H2S)
10、中草药秦皮中含有的七叶树内酯具有抗癌作用,其结构如下图所示。下列关于七叶树内酯的叙述中不正确的是 ( )
 A.属于芳香族化合物
A.属于芳香族化合物
B.能与浓溴水发生加成反应和取代反应
C.遇FeCl3溶液发生显色反应
D.1 mol该物质最多能与3mol NaOH发生反应
9、下列各组离子在溶液中既可以大量共存,且加入酚酞试液呈红色的是 ( )
A.Na+、Ba2+、Cl-、SO42- B.K+、AlO2-、NO3-、OH-
C.H+、NH4+、Al3+、SO42- D.H+、Cl-、CH3COO-、NO3-
8、下列有关化学实验的操作或说法中,正确的是 ( )
A.少量金属钠保存在煤油中
B.中和滴定实验中,锥形瓶内有少量蒸馏水会造成测定结果偏低
C.苯酚沾在皮肤上应立即用浓NaOH溶液洗涤
D.测定溶液的pH值时,用干燥、洁净的玻璃棒蘸取溶液,滴在用蒸馏水湿润过的pH试纸上,再与标准比色卡比较
7、用NA代表阿伏加德罗常数,下列说法正确的是 ( )
A.17g羟基(-OH)所含电子总数为10NA
B.在100mL0.5 mol•L-1CH3COOH溶液中CH3COOH分子数等于0.05NA;
C.标况下,22.4LCH4中所含共价键的数目为4NA;
D.1molCl2通入足量的NaOH溶液中充分反应转移的电子数为2NA;
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com