
题目列表(包括答案和解析)
6.在pH=a的某电解质溶液中,插入两支惰性电极,通直流电电解一段时间后,溶液的PH=b,若a>b,则该电解质可能是
A.CuSO4 B.Na2SO4
C.NaOH D.HCl
5.短周期元素A、B、C,原子序数依次递增。已知:A、C同主族,而且三种元素原子的最外层电子数之和为15,B原子最外层电子数等于A原子最外层电子数的一半。下列叙述正确的是
A.原子半径:A<B<C
B.沸点:A的氢化物低于C的氢化物
C.B的硫酸盐溶液pH<7
D.5.6g铁与足量的C化合,转移0.3mol电子
4.有机物甲可氧化生成羧酸,也可还原生成醇。由甲生成的羧酸和醇在一定条件下,可以生成化合物乙,其分子式为C2H4O2。下列叙述中不正确的是
A.甲分子中碳的质量分数为 40%
B.乙比甲的沸点高
C.乙和甲的最简式不相同
D.甲氧化生成的羧酸分子结构中含有醛基
3.在下列数量含有10电子的物质中:
①质量为34.0g的氨气;
②标准状况下体积为11.2L的氟化氢;
③4℃时体积为22.4mL的纯水;
④标准状况下体积为22.4L的甲烷。所含质子数由多至少的正确排列是
A.②>①>③>④ B.①>③>④>②
C.④>②>①>③ D.①>④>③>②
2.Na2FeO4是一种高效多功能水处理剂,应用前景广阔。一种制备Na2FeO4的方法可用化
学方程式表示如下:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑
对此反应下列说法中不正确的是
A.Na2O2在反应中只作氧化剂
B.O2是氧化产物
C.Na2FeO4既是氧化产物又是还原产物
D.2mol FeSO4发生反应时,共有10mol电子转移
1.2008年北京奥运会主体育场的外形好似“鸟巢” (The Bird Nest)。有一类硼烷也好似鸟巢,故称为巢式硼烷。巢式硼烷除B10H14不与水反应外,其余均易与水反应生成氢气和硼酸,硼烷易被氧化。下图是三种巢式硼烷,有关说法正确的是
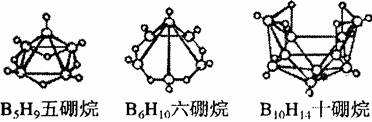
A.这类巢式硼烷的通式是BnHn+4
B.1molB5H9完全燃烧转移25mol电子
C.8个硼原子的巢式硼烷化学式应为B8H10。
D.硼烷与水反应是非氧化还原反应
12.(14分)某课外活动小组设计了如图所示的装置。用于进行缓慢电解NaCl溶液及相关实验(此时打开止水夹a,关闭止水夹b)。由于某些原因,实验开始并没有达到预期的目的,但也看到了令人高兴的现象(阳离子交换膜只允许阳离子和水的通过)。请帮他们分析原因,然后回答问题:
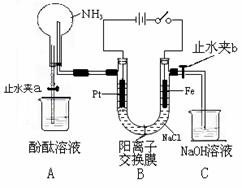 (1)写出B装置
(1)写出B装置 中的电极反应:
中的电极反应:
阴极:
阳极:
(2)一段时间内依次观察到A中的现象为:
①
②
③
(3)当观察完A中的现象后,打开止水夹b。再观察C装置,若无现象说明理由,若有现象请写出有关反应的化学方程式
(4)若想达到电解NaCl溶液的目的,请对该装置进行最简单的改进
11.(16分)t℃ 时,将2mol N2和1mol H2通入体积为2 L的恒温恒容密闭容器中,发生如下反应:
N2 ( g
) +3H2 ( g )  2NH3
(g );ΔH <0
2NH3
(g );ΔH <0
2min后反应达到平衡,此时测得NH3的物质的量为0.2 mo1。请填写下列空白:
(1)从反应开始至达到化学平衡,生成NH3的平均反应速率为__ __;平衡时N2转化率为__ ___。
(2)下列叙述能证明该反应已经达到化学平衡状态的是(填标号,下同)__________
A.容器内压强不再发生变化 B.H2的体积分数不再发生变化
C.容器内气体原子总数不再发生变化 D.相同时间内消耗n molN2的同时消耗3n mol H2
E.相同时间内消耗n molN2的同时消耗2n mol NH3 F.容器内气体的密度不再发生变化
(3)反应达到化学平衡后,改变某个条件,引起平衡向正反应方向移动下列物理量数值一定增大的是_ _
A.N2的浓度 B.气体的平均分子量 C.生成NH3的物质的量 D.H2的转化率
(4)维持上述条件不变,加入a mol N2、b mol H2、cmol NH3,反应向逆方向进行,平衡时NH3的物质的量仍然为0.2 mo1,则c的取值范围是 。
(5)保持温度不变,使体积缩小为原来的一半,则N2的体积分数 (填“增大”、“减小”或“不变”)。请通过计算证明你的结论。
10.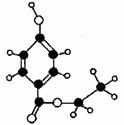 (16分)尼泊金酯是国际上公认的广谱性高效食品防腐剂,下图是一种尼泊金酯的球棍模型。回答问题:
(16分)尼泊金酯是国际上公认的广谱性高效食品防腐剂,下图是一种尼泊金酯的球棍模型。回答问题:
(1)请写出该物质的结构简式 ;
(2)该物质在一定条件下,能发生下图转化
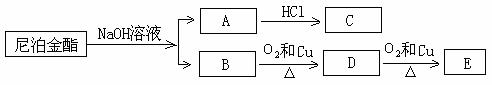
①1mol该尼泊金酯最多可以消耗 mol NaOH。
②向A中通入CO2,生成有机物的结构简式: 。
③B生成D的化学反应方程式:
(3)写出符合下列要求的C的同分异构体(至少写两种): ,
①能与新制的Cu(OH)2悬浊液反应(加热),产生红色沉淀;
②苯环上的一氯代物有两种。
(4)该尼泊金酯的一种同分异构体可以被银氨溶液氧化生成F,F在一定条件下能发生下列转化而生成香豆素,F→G的化学方程式:
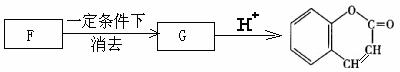
9.(14分)A、B、C是三种常见不同主族的短周期元素,它们的原子序数逐渐增大,B元素原子最外层电子数是C元素原子最外层电子数的一半,A元素原子最外层电子数比B多一个。甲、乙、丙是三种元素最高价含氧酸的钠盐,甲中含B元素,乙中含C元素,丙中含A元素,戊为淡黄色粉末。甲、乙、丙、丁、戊、已六种物质之间的相互反应关系如下图:(图中略去了物质转化时的部分生成物)
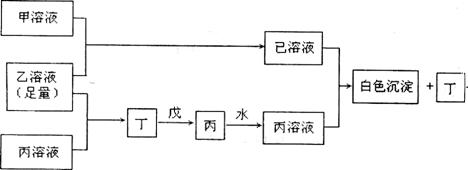
回答下列问题:
(1)写出A、B、C三种元素的元素符号 、 、 。
(2)写出戊的电子式 。
(3)若乙溶液不足量,乙溶液分别和甲、丙溶液也能发生化学反应,但生成物不是已和丁,写出不足量的乙溶液分别和甲溶液、丙溶液反应时的离子反应方程式:
乙+甲 ;乙+丙 。
(4)写出已溶液和丙溶液反应的离子方程式: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com