
题目列表(包括答案和解析)
5、如图锥形瓶中盛有气体X,滴管内盛有液体Y。若挤压滴管头,使Y滴
入瓶中,振荡,过一会儿可见小气球a鼓起。气体X和液体Y不可能是
A、X是NH3、Y是水 B、X是NO2、Y是NaOH溶液
C、X是CO2、Y是稀硫酸 D、X是HCl、Y是NaNO3溶液
4、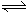 在温度不变时,恒容的容器中进行反应:2HI(g) I2(g)
+ H2(g) 若HI气体的浓度由0.1mol/L降到0.06mol/L时需要20s时间,那么HI由0.06mol/L降到0.036mol/L时所需的时间为
在温度不变时,恒容的容器中进行反应:2HI(g) I2(g)
+ H2(g) 若HI气体的浓度由0.1mol/L降到0.06mol/L时需要20s时间,那么HI由0.06mol/L降到0.036mol/L时所需的时间为
 A、10s
B、12s
C、>12s D、<12s
A、10s
B、12s
C、>12s D、<12s
3、用游码托盘天平(1克以下用游码)称量,已知药品的真实质量为9.5g,称量时,错误地把药品放在右盘,法码放在左盘,按这种方法称得的物品的质量是
A、10.0g B、10.5g C、11.0g D、11.5g
2、有关物质的用途叙述不正确的
A、碘化银、干冰均可用于人工降雨; B、皓矾、水玻璃均可做木材防腐剂
C、白磷、磷矿粉均可用于制磷酸 D、纯碱、小苏打均常用作洗涤剂
1、“飘尘”是物质燃烧时产生的粒状飘浮物,颗粒很小(直径小于10-7m)不易沉降(可飘浮数小时甚至数年)。它与空气中的SO2、O2等接触时,SO2会部分转化成SO3,使空气酸度增加,飘尘所起的主要作用是
A、氧化剂 B、还原剂 C、吸附剂 D、催化剂
12. 某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足
某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足
量镁带反应时,生成氢气的体积相同而反应速率
不同,同时测定实验室条件下的气体摩尔体积。
设计的简易实验装置如右图。该实验的主要操作
步骤如下:
①配制浓度均为1 mol·L-1盐酸和醋酸溶液;
②用 量取10.00 mL 1 mol·L-1
盐酸和醋酸溶液分别加入两个锥形瓶中;
③分别称取除去表面氧化膜的镁带a g,并系于铜丝
末端,a的数值至少为____________________;
④在广口瓶中装足量的水,按图连接好装置;检查装置的气密性;
⑤将铜丝向下移动,使足量镁带浸入酸中(铜丝不与酸接触),至反应完全,记录 ;
⑥反应结束后待温度恢复到室温,若丙中液面高于乙中液面,读取量筒中水的体积前,应 ,读出量筒中水的体积为V mL。
请将上述步骤补充完整并回答下列问题:
⑴用文字表述④检查该装置气密性的操作与观察方法:
____________。
⑵本实验中应选用 (填序号)的量筒。
A.100 mL B.200 mL C.500 mL
⑶若水蒸气的影响忽略不计,在实验室条件下,气体摩尔体积的计算式为Vm= 。
⑷简述速率不等的原因 ,铜丝不与酸接触的原因是 。
10、由短周期元素组成的A、B、C、D、E、F六种微粒,其中只有C、D是分子,其余四种是离子,且每个微粒中都含有10个电子。已知A、E是由非金属元素组成的阳离子,六种微粒间有下列关系:
①A、B两种离子在加热条件下可生成C、D两种分子;
②通常状况下C的聚集状态为气态,且可使湿润的红色石蕊试纸变蓝;
③1mol B离子与1mol E离子作用可生成2mol D分子;
④向含F离子的溶液中加入C的溶液,可生成白色沉淀W,C溶液过量沉淀也不消失,但再加入含大量B离子或大量E离子的溶液,沉淀W都会溶解。
(1)微粒A的电子式是_____________;微粒E的名称是_____________。构成微粒F的元素在元素周期表中的位置是__________________。
(2)写出下列反应的离子方程式:
F+过量C溶液:____________________________________________________
W+含大量B离子的溶液:____________________________________________
(3)六种微粒中的两种可与硫酸根形成盐,向这两种盐混合后的浓溶液中逐滴加入浓苛性钠溶液,产生的现象有:
a.溶液中出现白色沉淀
b.有刺激性气味气体放出
c.沉淀逐渐增多
d.沉淀完全消失
e.沉淀逐渐减少
上述各实验现象由先到后出现的正确顺序是(填写序号)___________________。
|
|
|



Br-CH2-CH2-O-C-CH2-CH-C-O-…………
已知:X在足量的氢氧化钠水溶液中加热,可得到A、B、C三种有机物。
|

②室温下A经盐酸酸化可得到苹果酸E,E的结构简式为HOOC-CH2-CH-COOH
请回答:
(1)E中含有的官能团是 ;
(2)C经酸化可得到有机物G,G可以发生的反应类型有 (填序号)
①加成反应 ②消去反应 ③氧化反应 ④取代反应
(3)B的结构简式为 ;
(4)E的一种同分异构体F有如下特点:1molF可以和3mol金属钠发生反应,放出33.6LH2(标况下),1molF可以和足量NaHCO3溶液反应,生成1molCO2,1molF还可以发生银镜反应,生成2molAg。则F的结构简式可能是(只写一种)
_________________________________
(5)在一定条件下两分子E可生成六元环酯,写出此反应的化学方程式
9.A、B两种物质都是由H、N、O、Na四种元素中任意三种元素组成的强电解质,A的水溶液呈碱性,B的水溶液呈酸性。请找出A和B可能的两种组合。要求:
①浓度相同时,第一种组合A溶液的pH大于第二种组合中A溶液的pH;
②当这两种组合中的B溶液的pH相等时,第一种组合的B溶液中水的电离程度小于第二种组合的B溶液中水的电离程度。
写出可能有的组合中A与B的化学式。
第一种组合:A ________________;B__________________;
第二种组合:A_________________;B__________________。
8.常温下,将V1 mL、c1 mol·L-1的氨水滴加到V2 mL、c2 mol·L-1的盐酸中,下列结论正确的是
A.若混合溶液的pH=7,则c1·V1>c2·V2
B.若V1=V2,c1=c2,则混合液中c(NH+4)=c(Cl-)
C.若混合液的pH=7,则混合液中c(NH+4)>c(Cl-)
D.若V1=V2,且混合液的pH<7,则一定有c1<c2
第二卷
7.合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:
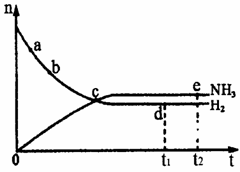
 N2(g)+3H2(g) 2NH3(g),△H<0,
N2(g)+3H2(g) 2NH3(g),△H<0,
在673K、30Mpa下n(NH3)和n(H2)
随时间变化的关系如图所示。下列叙述
正确的是
A.点c处反应达到平衡
B.点a的正反应速率比点b的大
C.点d(t1时刻)和点e(t2时刻)处n(N2)
不一样
D.其他条件不变,773K下反应至t1时刻,n(H2)
比图中d点的值小
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com