
题目列表(包括答案和解析)
7. 在一密闭容器中,反应mM(气) nN(气)达到平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,M的浓度为原来的80%,则
在一密闭容器中,反应mM(气) nN(气)达到平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,M的浓度为原来的80%,则
A.平衡逆向移动; B.物质M的转化率增大;
C.n > m D.物质N的质量分数减少
6.现有两种不含结晶水的盐,它们在不同温度下的溶解度分别是:
20℃ 50℃
A的溶解度 35.7g 46.4g
B的溶解度 31.6g 108g
下列说法中正确的是:
A.提纯A物质最好可采用重结晶的方法
B.若把108gB的饱和溶液从50℃降到20℃,析出的B是76.4g
C.提纯B物质最好可采用重结晶的方法
D.两种盐在某一温度下可能具有相同的溶解度
5.Na2O2、CaC2、CaH2、Mg3N2都能与水反应,且反应中均有气体放出。下列说法中正确的是
A.都属于氧化还原反应
B.Na2O2、CaC2与水反应时水作氧化剂
C.CaC2、Mg3N2与水反应属复分解反应
D.CaH2与水反应时产生H2,它既是氧化产物又是还原产物
4.2.8gFe全部溶于一定浓度、100mL的HNO3溶液中,得到标准状况下的气体1.12L,测得反应后溶液的pH为1。若反应前后溶液体积变化忽略不计,则下列有关判断不正确的是
A.反应前HNO3溶液的浓度为2.0mol·L-1 B.1.12L的气体全部为NO
C.反应后溶液中c(NO3-)=1.6mol·L-1 D.反应后的溶液最多还能溶解1.61gFe
3.能证明CH3COOH为弱电解质的实验是
① 分别测定浓度均为0.1mol·L-1的HCl溶液和CH3COOH溶液的pH;② 分别向浓度均为1mol·L-1的HCl溶液和CH3COOH溶液中投入大小外观基本相同的Zn粒;③ 测定一定浓度的CH3COONa溶液的pH;④ 将1.0mol·L-1的HCl溶液和1.0mol·L-1的CH3COOH溶液分别稀释100倍,并分别测定两种溶液稀释前后的pH;⑤ 将等浓度盐酸和醋酸分别滴加到等浓度的Na2CO3溶液中。
A.除⑤外均可以 B.只有①和③ C.全部 D.只有②和⑤
2.下列有关说法正确的是
A.H2SO4的酸性比HClO的酸性强,所以S的非金属性比Cl强
B.Mg(OH)2是中强碱,Al(OH)3是两性氢氧化物,所以Al的金属性比Mg强
C.H2O加热到1000℃开始分解,H2S加热到300℃开始分解,则O的非金属性比S强
D.用Na、Mg分别做与水反应的实验,可以比较它们的金属性强弱
1.氢元素与其他元素形成的二元化合物称为氢化物,下面关于氢化物的叙述正确的是
A.一个D2O分子所含的中子数为8 B.沸点:LiH>NaH
C.HCl的电子式为H+[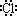 ]- D.熔沸点:HCl<HF
]- D.熔沸点:HCl<HF
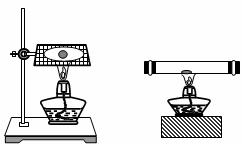
7.钠在空气中燃烧(下图)生成产物的固体物质中除有黄色粉末外,还有黑色固体物质--碳。
(1)请假设黑色固体物质可能产生的原因是:
假设① ;
假设② ;
假设③ 。
(2)为确认以上其中一种假设的正误,某同学进行如下推断:由于金属钠与氧的结合能力比碳强,因此黑色碳可能是二氧化碳与金属钠发生置换反应而生成。该同学设计实验如下:
甲打孔器钻取一段金属钠,取中间一小块钠放在充满二氧化碳气体的试管(上右图)中加热,观察到钠燃烧发出黄色火焰,并有黄色固体和黑色固体生成,生成的黄色固体立即变成白色。请回答下列问题:
①用打孔器这种方法取金属钠的原因是 ;
②产生以上现象的可能的化学反应方程式为: 。
答案:(1)①金属钠上没有擦干净的煤油不完全燃烧后生成碳,②酒精不完全燃烧生成的碳;③酒精燃烧产生的二氧化碳与金属钠反应生成的碳;④金属钠中含有杂质;⑤金属钠中的杂质反应后的生成物等(要求填三种即可)。
(2)①保证所取的是纯净的钠
②2Na+CO2 点燃 C+Na2O2,
2Na2O2+2CO2 点燃 2Na2CO3 +O2,或
Na2O2+2Na 点燃 2Na2O
6. 当前,一次性筷子、一次性饭盒的安全也受到社会的关注。专家介绍说,正规的一次性筷子所用的原料都是质地较好的木材,不用特殊加工。但是很多小作坊为了降低成本,使用劣质木材,为筷子看上去白一些,他们常用硫磺进行熏蒸漂白,结果造成二氧化硫严重超标,同时硫磺中含铅、汞等重金属,也会对人体造成铅中毒或汞中毒。
当前,一次性筷子、一次性饭盒的安全也受到社会的关注。专家介绍说,正规的一次性筷子所用的原料都是质地较好的木材,不用特殊加工。但是很多小作坊为了降低成本,使用劣质木材,为筷子看上去白一些,他们常用硫磺进行熏蒸漂白,结果造成二氧化硫严重超标,同时硫磺中含铅、汞等重金属,也会对人体造成铅中毒或汞中毒。
(1)“硫磺熏蒸”是应用二氧化硫的漂白性质,写出硫磺燃烧的化学方式_________________________________
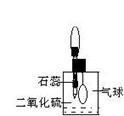
(2)防止、减小毒筷“中毒”最简单的方法是用凉水清洗筷子表面,减少二氧化硫的含量。为研究SO2的溶解性质,某学生做如下实验:如右图,集气瓶中收集的是SO2,瓶塞系着瘪气球,向瓶中滴加紫色石蕊试液,实验现象是________。为比较SO2 和CO2溶解性的大小,某学生采取同样的装置和操作,能说明SO2在水中的溶解性大于CO2在水中溶解性的实验现象是____________。某学生取出瓶中溶液,将其滴入品红溶液,充分振荡,实验现象为_______,接着向溶液中加入足量氯水,实验现象为_______,再滴加BaCl2溶液,实验现象为_____________。
答案:(1)S+O2 SO2
SO2
(2)紫色石蕊试液变红、气球鼓胀起来 SO2溶解时气球鼓胀的程度大于CO2溶解时气球的鼓胀程度 品红溶液的红色褪去(品红、SO2结合成不稳定的化合物),溶液显浅紫色(石蕊的颜色) 先变红后褪色(足量氯水能氧化SO2、石蕊和品红试液) 生成白色沉淀(BaSO4)。
5.2007年1月30日湖北107国道湖北孝感段发生危险化学品泄漏, 上百人中毒,1人死亡.经公安部门侦查及卫生部门医学诊断,判断为高毒类有机物硫酸二甲酯泄漏引发的人员中毒。该物质在有机合成中用作甲基化试剂(提供-OCH3)。但随着对此研究的深入,该有毒物质的应用范围越来越小,相信不久将被无毒的有机物M完全取代.
现有一种有机香料A是经过有机物M作为甲基化试剂合成的(注意:取代基不能全部相邻)。
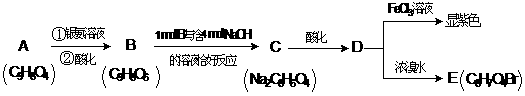
(1)
有机物M结构的球棍模型如图所示: 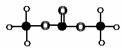
有机物M的分子式为: 名称为 ,
写出M在氢氧化钠溶液中反应的化学方程式: ;
(2)A分子中的官能团的是 ;(除甲氧基外)
(3)根据上述信息 (填可以或不能)确定A的结构式,理由是 ;
(4)A可以发生的反应是 (填符号);
a 还原反应 b氧化反应 c 酯化反应 d水解反应
(5)写出符合下列要求的A的同分异构体共有 种;
①含有苯环 ②能发生银镜反应 ③1mol该异构体能与2molNa反应
④苯环上只能生成三种一氯代物
(6)写出下列反应的化学方程式(有机物用结构简式表示),且指出反应类型。
A → B:
D → E:
答案:(1)C3H6O3;
碳酸二甲酯;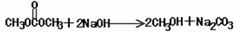
(2)醛基 ;酯基 (3)不能;两个取代基与酚羟基的位置有两种
(4)b d
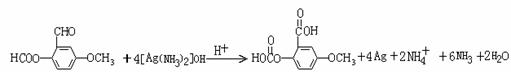
(5) 10
(6)
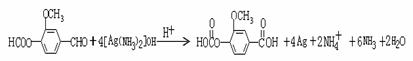 氧化反应
氧化反应
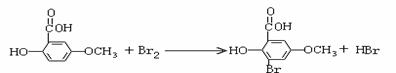 取代反应
取代反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com