
题目列表(包括答案和解析)
7.常温下,物质的量浓度均为0.1mol·L-1的两溶液HA、BOH。其中HA溶液的pH>1,BOH溶液中c(OH-)/c(H+)=1012,则下列有关说法正确的是
A.HA溶液中水的电离程度大于BOH溶液中水的电离程度
B.将HA、BOH溶液稀释相同的倍数,pH值变化前者大于后者
C.若两溶液混合时:V(BOH)≥V(HA) ,则必有混合液中c(B+)>c(A-)
D.将HA、BOH混合所得pH=7的溶液中必有c(B+)=c(HA)+c(A-)
6.下列各溶液中,微粒的物质的量浓度关系正确的是
A.10mL 0.5mol/L CH3COONa溶液与6mL 1mol/L盐酸混合:c(Cl-)>c(Na+)>c(H+)>c(OH-)
B.0.1mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-)
D.c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:
c[(NH4)2SO4]<c[(NH4)2CO3]<c(NH4Cl)
5.固体氧化物燃料电池(SOFC)以固体氧化物作为电解质。下列关于固体燃料电池的有关说法正确的是
A.通O2的电极为电池负极,电极反应式为O2+4e-=4O2-
B.固体氧化物的作用是让电子在电池内通过
C.若H2作为燃料气,则接触面上发生的反应为H2+2OH--4e-=2H++H2O
D.若C2H4作为燃料气,则接触面上发生的反应为C2H4+6O2--12e-=2CO2+2H2O
4.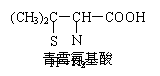 青霉素是医学上一种常用的抗生素,在体内经酸性水解后,得到青霉氨基酸,其结构简式如右图所示 (分子中的-SH与-OH具有类似性质)。下列关于青霉氨基酸的推断合理的是
青霉素是医学上一种常用的抗生素,在体内经酸性水解后,得到青霉氨基酸,其结构简式如右图所示 (分子中的-SH与-OH具有类似性质)。下列关于青霉氨基酸的推断合理的是
A.青霉氨基酸分子中所有碳原子均在同一直线上
B.青霉氨基酸具有两性并能发生酯化反应
C.青霉氨基酸分子间能形成多肽
D.1mol青霉氨基酸与足量的金属钠反应生成0.5mol H2
3.某含有Na+的澄清溶液中,可能还存在NH4+、Fe2+、I-、Br-、CO32-、SO32-六种离子中的几种。将该溶液进行如下实验:①滴加足量的新制氯水,有气泡生成,溶液变黄色;②向“①”中所得溶液中加入BaCl2溶液,无沉淀生成;③向“①”中所得溶液中加入淀粉溶液,不显蓝色。依据上述实验事实推断该溶液
A.一定存在Fe2+、Br-、CO32- B.一定呈碱性
C.一定不存在I-、SO32- D.可能存在NH4+
2.下列反应的离子方程式错误的是
A.NH4HSO4溶液中加入过量Ba(OH)2溶液:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
B.氢氧化铁与足量的氢溴酸溶液反应:Fe(OH)3+3H+=Fe3++3H2O
C.足量的CO2通入饱和碳酸钠溶液中:CO2+2Na++CO32-+H2O=2NaHCO3↓
D.将少量硝酸银溶液滴入氨水中:Ag++2NH3·H2O=[Ag(NH3)2]++2H2O
1.下列说法正确的是
A.阴阳离子间的通过相互吸引而形成离子键
B.含有非极性键的分子都不是极性分子
C.化学键只存在于分子内、原子间
D.原子晶体中一种或几种原子通过共价键形成立体网状结构
20.下列实验操作或叙述正确的是
①用pH试纸测得氯水的pH为2
②不宜用瓷坩埚灼烧氢氧化钠或碳酸钠固体
③为了提高纯锌与稀硫酸反应的速率,可向稀硫酸中滴入几滴CuSO4溶液;
④用蒸馏水润湿PH试纸溶液的PH一定有误差
⑤向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,可以制得Fe(OH)3胶体
⑥实验室配制氯化亚锡溶液时,可先将氯化亚锡溶解在盐酸中,再加入蒸馏水稀释,最后加入少量锡粒
⑦向饱和 NaCl 溶液中滴加浓硫酸制备 HCl
⑧亚硫酸钠与浓硫酸反应制备SO2
19. 对于以下给出的可逆反应:A+2B 2C(正反应放热),已知C是气体,达平衡后同时升高温度并降低压强,又达到新的平衡。若第二次平衡时混和物中C的含量与第一次平衡相同,则下列推断正确的是
对于以下给出的可逆反应:A+2B 2C(正反应放热),已知C是气体,达平衡后同时升高温度并降低压强,又达到新的平衡。若第二次平衡时混和物中C的含量与第一次平衡相同,则下列推断正确的是
A.A不一定是气态物质 B.A一定是气态物质
C.B一定不是气态物质 D.B一定是气态物质
18.已知Cu(NO3)2受热分解的化学反应方程式为: Cu(NO3)2==2CuO+4NO2+O2 ,某人将少量的Cu(NO3)2固体放入试管中加热,然后用带火星的木条放入试管中,木条复燃,则下列说法正确的是
A.NO2能支持燃烧
B.NO2不能支持燃烧
C.木条复燃是因为硝酸铜分解产生了氧气的缘故
D.木条复燃是因为硝酸铜分解产生了氧气和二氧化氮共同作用的结果
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com