
题目列表(包括答案和解析)
7、氧化性还原方程式的书写及配平原子量,化合价(近10年来的化学高考命题中的呈现率:90%)
 [点题]目前新一代高效、无污染的消毒剂二氧化氯(ClO2)已被许多国家广泛应用在饮用水的处理上。已知工业上制备二氧化氯的方法之一是用甲醇在酸性介质中与氯酸钠反应,其反应关系为CH3OH+NaClO3+H2SO4
ClO2+CO2+Na2SO4+H2O,则下列说法正确的是
[点题]目前新一代高效、无污染的消毒剂二氧化氯(ClO2)已被许多国家广泛应用在饮用水的处理上。已知工业上制备二氧化氯的方法之一是用甲醇在酸性介质中与氯酸钠反应,其反应关系为CH3OH+NaClO3+H2SO4
ClO2+CO2+Na2SO4+H2O,则下列说法正确的是
A.氧化剂是甲醇 B.氧化产物是二氧化氯
C.还原产物与氧化产物的物质的量之比为6:1
D.氧化剂与还原剂的物质的量之比为2:1
[点晴] C
6、氧化性、还原性、稳定性、活泼性的比较(近10年来的化学高考命题中的呈现率:100%)
[点题]在反应Zn+2HNO3+NH4NO3=N2+3H2O+Zn(NO3)2中每溶解1molZn,电子转移了
A.2mol B.3mol C.4mol D.5mol
[点晴]在读题时易靠惯性思维,认为溶解1mol Zn当然转移2mol电子,从而错选A,这种惯性思维导致根本不通过标变价的方法观察是否有其他元素也在失e-。越是感觉简单的题目越要当心,因为这其中有可能存在陷阱,另外,考试时应养成动笔的习惯,不要仅凭观察和感觉选项,把送到手的分丢掉。故选D。
5、核外电子排布,推导化学式(近10年来的化学高考命题中的呈现率:100%)
[点题] 镓是1871年俄国化学家门捷列夫在编制元素周期表时曾预言的“类铝”元素。镓的原子序数为31,属ⅢA族。镓的熔点为29.78℃,沸点高达2403℃。镓有过冷现象(即冷至熔点下不凝固),它可过冷到-120℃。由此判断下列有关镓的性质及其用途的叙述不正确的是
A.镓是制造高温温度计的上佳材料 B. 镓能溶于强酸和强碱中
C.镓与锌、锡、铟等金属制成的合金,可用在自动救火的水龙头中
D.近年来镓成为电子工业的新宠,其主要用途是制造半导体材料,被誉为“半导体材料的新粮食”,这是利用了镓的导电性介于导体和绝缘体之间的性质
[点晴] D 。
[点题] 法国里昂的科学家最近发现一种只由四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”。下列有关“四中子”粒子的说法不正确的是
A.该粒子不显电性 B.该粒子质量数为4
C.在周期表中与氢元素占同一位置 D.该粒子质量比氢原子大
[点晴] C。
[点题] A、B两元素的原子分别得到2个电子形成稳定结构时,A放出的能量大于B放出的能量;C、D两元素的原子分别失去1个电子形成稳定结构时,D吸收的能量大于C吸收的能量。若A、B、C、D间分别形成化合物,属于离子化合物的可能性最大的是
A.D2A B.C2B C.C2A D.D2B
[点晴]本题考察金属、非金属元素原子结构特征、离子化合物形成特点及与能量的关系。要善于从能量的变化来判断金属性、非金属性的强弱。根据A、B得2个电子,C、D失1个电子均达稳定结构,判断A、B为ⅥA族元素,再根据能量越低越稳定的原则,A形成稳定离子时放出能量大于B,说明A非金属性强于B,C形成稳定离子时吸收能量小于D,说明C金属性强于D,所以C、A最易形成离子化合物C2A。能量越低越稳定的原则是化学变化中的基本原则,但同学们对这一点很不敏感,在今后的学习中应注意这一问题。故选C。
[点题]下列六种化合物(A-F)中含有的元素不多于三种,且分子内所含X、Y元素的质量分数及化合物的部分性质列于下表。
|
化合物 |
A |
B |
C |
D |
E |
F |
|
ω(x) |
0.1653 |
0.2069 |
0.2781 |
0.4211 |
0.8743 |
0.2089 |
|
ω(y) |
0.8347 |
0.7852 |
0.7019 |
0.5338 |
0 |
0.7911 |
|
常压下t℃的 密度g/cm3 |
1.448 (20℃) |
1.145 (-113℃) |
1.42 (-122℃) |
2.97×10-3 (0℃) |
0.68(-168℃) |
- |
|
沸点/℃ |
57 |
30.4 |
8.3 |
-12 |
-111.8 |
145 |
|
熔点/℃ |
-70.4 |
-118 |
-122 |
-130 |
-185 |
3 |
|
分子极性 |
非极性 |
极性 |
极性 |
极性 |
非极性 |
- |
根据上表有关信息回答下列问题:计算化合物D的相对分子质量。
确定六种化合物的化学式,写出推理和计算过程。
[点晴] (1) 66.5 (2) 要点之一:D中所含的另一种元素的总式量为:66.5×(1-0.4211-0.5338)=3,元素的相对原子质量比3小的唯有H元素,故D分子中必有3个氢原子。要点之二:据要点之一,推定E为氢化物,设其分子式为XHn ,X的相对原子质量为a,则: ,a=7n,经讨论,当n=4,a=28时符合题意。因此X为Si
,a=7n,经讨论,当n=4,a=28时符合题意。因此X为Si
要点之三:据要点一与要点二可立即假设D为SiH3Y。 要点之四:设Y的相对原子质量为b, 据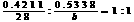 得b=35.5,故Y是Cl
得b=35.5,故Y是Cl
要点之五:由F中X、Y的质量分数,可求得其最简式为SiCl3,从价态不难得出F的分子式为Si2Cl6,因此各物质分别为:A.SiCl4; B.SiHCl3; C.SiH2Cl2; D.SiH3Cl; E.SiH4; F.Si2Cl6
4、热化学方程式(近10年来的化学高考命题中的呈现率:70%)
[点题]实验室用4mol SO2与2mol O2进行下列反应: 2SO2(g)+O2(g)  2SO3(g);
2SO3(g);
ΔH=―196.64KJ/mol,当放出314.624KJ热量时,SO2的转化率为
A.40% B.50% C.80% D.90%
[点晴] A
[点题]甲醇是一种重要的醇,它可以做内燃机的燃料和溶剂,也是一种重要的化工原料,同时它在废水处理中也有重要应用。
(1)在25℃时1g甲醇完全燃烧后恢复至原温度时可放出24.2kJ热量,则25℃时1mol甲醇完全燃烧生成100℃时CO2和水蒸气应放出 J热量。(保留整数)(有关热量公式Q=m·C·△t Q=m·J, 已知水的比热C=4.18J·g-1·℃-1,水的液化热J=2253J·g-1
m:物质质量 △t:温度差 假设100℃时水完全汽化,并忽略CO2吸热)
(2)甲醇加入含氨的废水中,在一种微生物作用下发生反应:
2O2+NH3=NO3-+H++H2O, 6NO3-+6H++5CH3OH→3N2↑+5CO2↑+13H2O
若某废水用上述方法处理时,NH3→NO3-的转化率为95%,NO3-→N2的转化率为86%。若每天处理此种含NH3为34mg/L的废水500m3(密度1g/cm3)需要甲醇多少千克?(要求写出解题步骤,保留至小数点后一位)
[点晴](1)682;
(2)解:由反应2O2+NH3=NO3-+H++H2O,
6NO3-+6H++5CH3OH→3N2↑+5CO2↑+13H2O
得关系式:6NH3-6NH3--5CH3OH-3N2↑
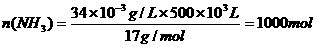
 根据关系式6NH3
5CH3OH
根据关系式6NH3
5CH3OH
6mol 5×32×10-3kg
1000mol×95%×86% m(CH3OH)

答:消耗甲醇21.8kg
3、阿氏常数(近10年来的化学高考命题中的呈现率:90%)
[点题]设NA为阿伏加德罗常数值,下列叙述中不正确的是
A.12.4g白磷晶体中含有的P-P键数是0.6NA
B.2.9g2CaSO4·H2O 含有的结晶水分子数为0.02 NA
C.100 g的98%的浓 H2SO4中所含的硫原子数为2NA
D.2molSO2和1molO2 混合在V2O5存在的条件下密闭容器中加热反应后,容器内物质分子数大于2 NA
[点晴] 此类题多注意NA的涵义,掌握物质的量与粒子数目、气体体积(标况下)之间的相互关系。n(P4)=0.1mol 每个白磷分子含有6个P-P键数,所以A 正确;M(2CaSO4·H2O )=290mol/L ,所以n(H2O)=0.01mol ,B错! C:n(H2SO4)=1mol ,D :SO2 与O2反应是可逆的。故选B。
1、化学史、环境保护、石油及煤化工(近10年来的化学高考命题中的呈现率:100%)
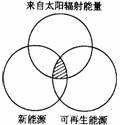 [点题] “能源分类相关图”如下图所示,下列四组选项中,全部符合图中阴影部分的能源是
[点题] “能源分类相关图”如下图所示,下列四组选项中,全部符合图中阴影部分的能源是
A.煤炭、石油、沼气 B.水能、生物能、天然气
C.太阳能、风能、潮汐能 D.地热能、海洋能、核能
[点晴] C。
[点题] “绿色化学”是21世纪化学发展的主导方向。“绿色化学”要求从根本上消灭污染。其中“化学反应的绿色化”要求原料物质中所有的原子完全被利用且全部转入期望的产品中。下列符合“化学反应的绿色化”的是
 ①.用铁屑、氧化铜、稀硫酸为原料制取铜:CuO+H2SO4=CuSO4+H2O,Fe+CuSO4=FeSO4+Cu
①.用铁屑、氧化铜、稀硫酸为原料制取铜:CuO+H2SO4=CuSO4+H2O,Fe+CuSO4=FeSO4+Cu
 ②.用甲烷、一氧化碳合成乙酸乙酯:2CH4+2CO
CH3COOC2H5
②.用甲烷、一氧化碳合成乙酸乙酯:2CH4+2CO
CH3COOC2H5
③.乙烯催化氧化制乙醛: 2C2H4+O2 CH3CHO
④.2M+N=2P+2Q,2P+M=Q (M、N为原料,Q为期望产品)
A.②③④ B.①②④ C.①③④ D.①②③
[点晴]①反应的产物除期望的产品Cu以外,还有CuSO4、FeSO4和H2O,不合题意。②、③、④三个反应的产物都只有所期望的产品,符合题意。故选A。
[点题] 飘尘是物质燃烧时产生的粒状漂浮物,颗粒很小,不易沉降,它与空气中SO2、O2接触时,SO2会部分转化为SO3,使空气的酸度增加,飘尘所起的作用可能是①氧化剂; ②还原剂; ③催化剂; ④吸附剂。
A.①② B.① C.①③ D.③④
[点晴] SO2在一定温度和催化剂作用下,可会被O2氧化成SO3。飘尘在上述变化中,未参与氧化还原反应,而是起催化剂和吸附剂的作用。故选D。
[点题] H2C=CHOH不稳定,在常温下为液体,很容易转化成稳定的CH3CHO。然而,2002年的美国《科学》杂志报道:外太空的某一个星球的大气层含有大量的H2C=CHOH。请预测该星球的温度是
A.较低温度 B.较高温度 C.无法判断温度的高低 D.上述说法都不正确
[点晴] B。 2、物质的量、摩尔质量、微粒数、体积比、密度比(近10年来的化学高考命题中的呈现率:100%)
[点题] 在4℃时向100ml水中溶解了22.4LHCl气体(标准状态下测得)后形成的溶液。下列说法中正确的是
A.该溶液物质的量浓度为10mol/L B.该溶液物质的量浓度因溶液的密度未知而无法求得
C.该溶液中溶质的质量分数因溶液的密度未知而无法求得 D.所得的溶液的体积为22.5L
[点晴] 解此类题的秘诀就在于从定义出发,找源头。气体与液体混合体积不能简单加和,液体与液体混合,如果给出密度也不能简单加和!溶液的体积不等于溶剂的体积。本题的溶质的质量与溶液的质量可求得:36.5g, 100g,所以可求出质量分数。选项A:溶液的体积不能简单等于0.1L,便可推知该溶液物质的量浓度不应等于10mol/L。选项D:溶液的体积不能是溶质与溶剂的简单加和。即不等于22.5L。故选B。
(一)(1)硫酸钡。(2)盐酸,溶液中不再产生气体。
(3)Ca2++CO32-==CaCO3↓、Ba2++CO32-==BaCO3↓、Mg2++2OH-==Mg(OH)2↓
(4)E,容量瓶。(二)C、D、G、F(三)B,分液漏斗,萃取。
考点20.化学计算:
1.掌握有关相对原子质量、相对分子质量及确定分子式的计算;2.掌握有关物质的量的计算;3.掌握有关气体摩尔体积的计算;4.掌握有关溶液浓度(溶液中溶质的质量分数和物质的量浓度)的计算;5.掌握利用化学反应方程式的计算;6.掌握有关物质溶解度的简单计算;7.掌握有关溶液pH与氢离子浓度、氢氧根离子浓度的简单计算;8.掌握有关燃烧热的简单计算;9.以上各类化学计算的综合应用。
例20-1.江苏是一个沿海城市,具有对海水综合开发利用得天独厚的条件。如图是氯碱工业生产的工作原理图。回答下列有关问题:
(1)该电解槽的阳极反应式是 ,生产所得氢氧化钠溶液从出口 (填写“A”或“B”)导出。
(2)某工厂电解质量分数为23.4%的精制食盐水a kg,电解后残液的密度为ρ kg/L。将产生的H2、Cl2在一定条件下反应制成质量分数为36.5%的盐酸b kg,已知H2、C12的利用率均为c%。则残液中氯化钠的质量分数(用含a、b、c的代数式表示)和氢氧化钠的物质的量浓度(用含a、b、c、ρ的代数式表示)各是多少?
 答案: (1)w(NaCl)=
答案: (1)w(NaCl)=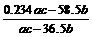 ×100% (2)c(NaOH)=
×100% (2)c(NaOH)=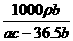 mol/L
mol/L
例20-2.工业上利用焦炭在石灰窑中燃烧放热,使石灰石分解生产CO2。主要反应如下:
C+O2→CO2 ①, CaCO3→CO2↑+CaO ②
(1)含碳酸钙95%的石灰石2.0 t按②完全分解(设杂质不分解),可得标准状况下CO2的体积为_________________m3。
(2)纯净的CaCO3和焦炭混合物m g在石灰窑中完全反应,所得CO2的物质的量范围是_______________________。
(3)纯净的CaCO3和焦炭按①②完全反应,当窑内配比率n(CaCO3)/n(C)=2.2时,窑气中CO2的最大体积分数为多少?(设空气只含N2与O2,且体积比为4∶1,下同)
(4)某次窑气成分如下:O2 0.2%,CO 0.2%,CO2 41.6%,其余为N2。则此次窑内配比率n(CaCO3)/n(C)为何值?
答案:(1)425.6;(2) mol< n(CO2)<
mol< n(CO2)< mol;(3)44.4%;(4)1.90
mol;(3)44.4%;(4)1.90
例20-3.工业生产粗硅的主要原理为:SiO2 + 2C  Si(粗)
+2CO↑
Si(粗)
+2CO↑
(1)若在制粗硅的过程中同时生成了碳化硅,且二者物质的量之比为1∶1,则参加反应的C和SiO2的质量比为 。
(2)工业上可通过下面原理由粗硅进一步制纯硅:
Si(粗) + 2Cl2(g)  SiCl4(l) SiCl4 + 2H2
SiCl4(l) SiCl4 + 2H2
 Si(纯)
+ 4HCl
Si(纯)
+ 4HCl
若上述反应中Si(粗) 和SiCl4的利用率均为80%,制粗硅时有10%的SiO2转化为SiC,则生产25.2吨纯硅需要纯度为75%石英多少吨?
(3)工业上还可以通过如下图所示的流程制取纯硅:

反应①:Si(粗) + 3HCl(g)  SiHCl3(l) + H2(g)
SiHCl3(l) + H2(g)
反应②:SiHCl3
+ H2  Si(纯)
+ 3HCl
Si(纯)
+ 3HCl
假设在每一轮次的投料生产中,硅元素没有损失,反应①HCl中的利用率为75%,反应②中H2的利用率为80%。则在下一轮次的生产中,需补充投入HCl和H2的体积比是多少?
答案:
(1)1∶2 ;(2)125吨;(3)4∶1
(三)海带等藻类物质经过处理后,可以得到碘水,欲从碘水中提取碘,需要上述仪器中的 (填字母),该仪器名称为 ,向该碘水中加入四氯化碳以提取碘单质的实验操作称为 。
(二)海水蒸馏是由海水获得淡水的常用方法之一,在实验室组成一套蒸馏装置肯定需要上述仪器中的一部分,按照实验仪器由下向上,从左到右的顺序,这些仪器依次是
(填字母)。
(一)从海水得到的粗食盐水常含Ca2+、Mg2+、SO42-,需要分离提纯。现有含少量CaCl2、MgSO4的粗食盐水,在除去悬浮物和泥沙之后,要用4种试剂①盐酸、②Na2CO3、③NaOH、④BaCl2来除去食盐水中的Ca2+、Mg2+、SO42-。提纯时的操作步骤和加入试剂的情况如图。
图中a、b、c、d分别表示上述4种试剂中的各一种,试回答:
 (1)沉淀A的名称是
。
(1)沉淀A的名称是
。
(2)试剂d是 ;判断试剂d已经足量的方法是 。
(3)加入b、c后溶液中发生的化学反应的离子方程式为 。
(4)现有下列仪器,过滤出沉淀A、B、C时必须用到 (填字母),仪器A的名称是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com