
题目列表(包括答案和解析)
17、化学键,晶体类型及性质(近10年来的化学高考命题中的呈现率:70%)
[点题]最近发现一种有钛原子和碳原子构成的气态团簇分子,结构如NaCl晶体图所示,顶角和面心的原子是钛原子,棱的中心和体心的原子是碳原子,它的化学式为______。 [点晴] 错误解答:由结构图可知,顶点上的原子被8个晶胞共用,面心上的原子被两个晶胞共用,棱的中心的原子被4个晶胞共用,而体心中的原子被一个晶胞专用。根据这样的思路:每个晶胞中Ti的个数为8*(1/8)+6*(1/2)=4;C的个数为1+12*(1/4)=4。因此每个晶胞中有4个Ti和4个C,该物质的化学式为Ti4C4(或TiC也可以)。错误原因:忽略指定的结构为“气态团簇分子”,把它按常规的“晶胞”处理。正确解答:由于该结构为“气态团簇分子”,给出的结构就是一个“完整”的分子,因此结构中的每个原子都是构成分子的一部分。由于该“气态团簇分子”结构含有14个Ti和13个C,于是该物质的化学式为Ti14C13。
[点题] 纳米材料的表面粒子占总粒子数比例极大,这是它有许多特殊性质的主要
原因。假设某纳米颗粒的大小和结构恰好与氯化钠晶胞(最小结构单元)相同
 (如右图所示),则这种纳米颗粒的表面粒子数与总粒子数的比值为
(如右图所示),则这种纳米颗粒的表面粒子数与总粒子数的比值为
A.7:8 B.13:14 C.25:26 D.26:27
[点晴] D 。
[点题]下列说法中正确的是
A.冰、水和水蒸气中都存在氢键
B.除稀有气体外的非金属元素都能生成不同价态的含氧酸
C.金属离子和自由电子间通过金属键形成的晶体是金属晶体
D.CO2与SiO2都是分子晶体,所以它们有接近的熔、沸点
[点晴] 水分子之间存在形成氢键,水蒸气中不一定含有氢键;B中F、O没有含氧酸;D中SiO2是原子晶体。故选C。
 [点题]钛酸钡的热稳定性好,且介电常数高,它在小型变压器中应用很多,在话筒和扩音器中用作陶瓷变频器。其晶体结构示意如图,试回答:
[点题]钛酸钡的热稳定性好,且介电常数高,它在小型变压器中应用很多,在话筒和扩音器中用作陶瓷变频器。其晶体结构示意如图,试回答:
16、电化学知识(近10年来的化学高考命题中的呈现率:100%)
[点题]用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入0.1mol Cu(OH)2后恰好恢复到电解前的浓度和PH。则电解过程中转移的电子数为( ) A、0.1mol B、0.2mol C、0.3mol D、0.4mol [点晴] 错误解答:选B。由于电解后加入0.1mol Cu(OH)2,恰好恢复到电解前,而0.1mol Cu(OH)2中含0.1molCu2+,即反应过程中有0.1molCu2+被还原,因此电解过程中共有0.2mol电子发生转移。错误原因:对电解硫酸铜溶液的反应没有深入的掌握,而且忽略了题目中加入的物质为Cu(OH)2。正确解答:电解硫酸铜溶液的反应方程式为: 2CuSO4 + 2H2O = 2Cu+ 2H2SO4 + O2↑ 从上述方程式可以看出,电解硫酸铜过程中,只析出铜和释放出氧气。因此,电解前后只有铜和氧的改变,电解后加入CuO就可以使溶液恢复原来状态。但本题提示加入Cu(OH)2后溶液恢复原来状态,说明电解过程中不仅硫酸铜被电解,而且有水被电解(因为硫酸铜被电解完全)。0.1molCu(OH)2可以可以看作是0.1mol的CuO和0.1mol H2O,因此电解过程中有0.1mol的硫酸铜和0.1mol的水被电解。故选D。 [点题]消毒、杀菌,是抗“非典”消毒剂。一种家用环保消毒液产生装置。其原理中用石墨作电极电解饱和氯化钠溶液,制得有较强杀菌能力的消毒液,该仪器的原理如图所示,
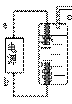 试回答:(1)“84”消毒液在日常生活中被广泛使用。该消毒液无色,
试回答:(1)“84”消毒液在日常生活中被广泛使用。该消毒液无色,
pH大于7,对某些有色物质有漂白作用。你认为它可能的有效成分
是 A.SO2 B.Na2CO3 C.KMnO4 D.NaClO
(2)写出电极名称 a极 ,b极 。
(3)消毒液的有效成分是 。
(4)写出有关离子方程式 。
(5)若在电解过程中因温度上升,生成了少量的NaClO3,即发生了反应:3Cl2 + 6 NaOH =5 NaCl + NaClO3 + 3H2O 测量得n (NaClO):n(NaClO3) = 5∶1,则整个过程中,氧化产物与还原产物的物质的量之比是 。
[点晴] (1)D(2)由"为使氯气完全被吸收"应在电解槽下部产生氯气,故a极为负极,b极为正极。(3)由方程式:Cl2 + 2 NaOH = NaCl + NaClO + H2O有效成分为:NaClO
(4)2Cl- + H2O=2 OH- + H2↑ + Cl2↑ Cl2 + 2OH-= Cl- + ClO- + H2O
(5)由于整个过程氯气完全被吸收,氯化钠、水为原料,所以H2、 NaClO与NaClO3为产物;其中H2为还原产物,和为氧化产物,由:1mol Cl→1mol ClO-失电子2 mol,1mol Cl→1mol ClO3-失电子6 mol,若设NaClO为5 mol则NaClO3为1mol,氧化产物为6mol,共失电子:5 mol×2 + 6 mol = 16mol,而生成1mol H2需转移电子2mol,则:n(H2)= 16mol/2 = 8 mol,故氧化产物与还原产物的物质的量之比是: 6:8=3:4
 [点题]熔融碳酸盐燃料电池(MCFS),发明于1889
[点题]熔融碳酸盐燃料电池(MCFS),发明于1889
年,上世纪的30~60年代在荷兰得到广泛的发
展,而且建成了寿命超过40000小时的电池,
可应用于中心电站。
现有一个碳酸盐燃料电池,以一定比例
Ll2CO3和Na2CO3低熔混合物为电解质。操作温
度为650℃,在此温度下以镍为催化剂,以煤
气(CO、H2)直接作燃料,其工作原理如图所示。
请回答下列问题:
(1)B极为 极,发生 (填“氧化”或“还原”)反应,该极发生的电极反应为 ;
|
|
 CO2 +H2O
CO2 +H2O15、盐类的水解(近10年来的化学高考命题中的呈现率:100%)
[点题]等物质的量浓度的下列物质的溶液,其PH值由大到小的顺序是
(1)NaCl (2)CH3COONa (3)NH4Cl (4)AlCl3 (5) 苯酚钠溶液(6)Ba(OH)2 (7)Na2CO2 (8)NaHCO3 (9)NaHSO4 (10)NaOH (11)H2SO4
[点晴]首先将11种物质按碱,水解显碱性的盐不水解的盐,水解显酸性的盐、酸分成五类,再分段判断PH值大小,正确答案是(6)>(10)>(7)>(5)>(8)>(2)>(1)>(3)>(4)>(9)>(11)
14、化学反应速率、化学平衡(近10年来的化学高考命题中的呈现率:90%)
[点题] 在一定条件下的密闭容器中进行反应A(g)+2B(g) 3C(g),已知起始时
3C(g),已知起始时
入n molA和3n molB,平衡时C的物质的量为m mol,若改变条件,可使C的物质的量
m~2m之间变化,则n与m的关系是( )
A.n<m B.m=2n C.m<1.5n D.n>m
[点晴] C 。
[点题]温度为T℃,压强为1.01×106Pa条件下,某密闭容器下列反应达到化学平衡A(g)+ B(g) 3C(?),测得此时c(A)=0.022 mol·L-1;压缩容器使压强增大到2.02×106Pa,第二次达到平衡时,测得c(A)=0.05 mol·L-1;若继续压缩容器,使压强增大到4.04×107Pa,第三次达到平衡时,测得c(A)=0.75 mol·L-1;则下列关于C物质状态的推测正确的是
3C(?),测得此时c(A)=0.022 mol·L-1;压缩容器使压强增大到2.02×106Pa,第二次达到平衡时,测得c(A)=0.05 mol·L-1;若继续压缩容器,使压强增大到4.04×107Pa,第三次达到平衡时,测得c(A)=0.75 mol·L-1;则下列关于C物质状态的推测正确的是
A.C为非气态 B.C为气态
C.第二次达到平衡时C为气态 D.第三次达到平衡时C为非气态
[点晴] C D。
13、溶液的浓度、溶解度(近10年来的化学高考命题中的呈现率:60%)
[点题]25℃时,硫酸铜的溶解度为Sg,将Sg无水硫酸铜粉末加入到(100+S)g饱和到铜溶液中,得到一定量的蓝色晶体,若将此晶体溶解配制成饱和溶液,应加入的水的质量是
A.100g B.(100+S)g C.(100-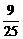 )g D.(100-
)g D.(100- )g
)g
[点晴]很多学生拿到本题就开始列未知数解方程,试图算出答案,结果发现所给数据过于抽象,计算量过大而放弃,其实将题目通览后通过流程图不难发现:

将晶体溶解所加的水量就是将Sg无水硫酸铜配成饱和溶液所需的水量,即100g。故选A。
[点题]在100g浓度为18mol/L、密度为ρ(g/cm3)的浓硫酸中加入一定量的水稀释成9mol的硫酸,则加入的水的体积为
A 小于100mL B 等于100mL C 大于100mL D 等于100/ρmL
[点晴]硫酸密度随浓度的减小而减小,设稀释后的硫酸密度为ρ1g/L.则ρ1<ρ。
(100/ρ)×18=[(100+ρ水×V水)/ρ1]×9
V水=(200ρ1/ρ)-100 因ρ1<ρ则V水<100mL。
[点题]酒瓶的标鉴上有55℃的字样,它表示
A.该酒在55℃的条件下酿造 B.该酒的沸点为55℃100mL
C.该酒中含乙醇55mL100g D.该酒中含乙醇55g
[点晴] 化学的考查离不开化学在社会生活中的应用,如:环境、能源、医药、材料等。而这一方面往往我们学生致命的弱点。在高考化学试题中,对这方面知识也进行了一定程度的考查。现将日常生活中的化学问题列举如下:无铅汽油、可降解饭盒、无磷洗衣粉、含氟牙膏的使用,旧电池的回收,食用含碘盐,明矾净水及各种消毒剂的使用,钢铁腐蚀,各种新型电池等。当今的环境问题主要包括:温室效应、酸雨、臭氧层被破坏、光化学烟雾、白色污染、赤潮、含磷洗衣粉的使用、重金属及其盐的污染、沙漠化等。解决好这类问题关键在于知识的积累和化学原理的应用。溶质为液体时,配制的溶液是有体积分数表示。故选C。
[点题]实验室里需480mL1.0mol/LNaOH溶液,若用固体NaOH配制,则应取NaOH的质量为 A.19.2g B.20.0g C.29.6g D.39.2g
[点晴]480mL1.0mol/LNaOH溶液有19.2gNaOH(s),但实验室中没有480mL容量瓶。有500mL容量瓶,故应称取NaOH固体20.0g。选B。
12、溶液浓度、离子浓度的比较、pH值及计算(近10年来的化学高考命题中的呈现率:100%)
[点题]欲使0.1mol-1K2CO3溶液中[K+]=2[CO ],应采取的措施是
],应采取的措施是
A.加少量盐酸 B.加适量的KOH C.加适量的水 D.加适量的NaOH
[点晴]本题要运用平衡移动原理,解题时首先看清是电离平衡的移动还是水解平衡的移动,K2CO3溶液中存在水解平衡:CO +H2O
+H2O 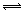 HCO
HCO +OH-导致[K+]>2[CO
+OH-导致[K+]>2[CO ],若使[CO
],若使[CO ]升高,应使水解平衡向左移动,则应引入少量OH-,而加入KOH会同时增加[K+],所以只能加适量的NaOH,A错在能使平衡向左移动,但实际消耗3CO
]升高,应使水解平衡向左移动,则应引入少量OH-,而加入KOH会同时增加[K+],所以只能加适量的NaOH,A错在能使平衡向左移动,但实际消耗3CO ,[CO
,[CO ]不升反降,C错在稀释促进CO
]不升反降,C错在稀释促进CO 水解,[CO
水解,[CO ]会下降。故选D。
]会下降。故选D。
[点题]混合Na2S跟NaHS两溶液,此混合溶液中,下列关系一定正确的是( )
A.[Na+]+[H+]==2[S2-]+[HS-]+[OH-] B.[Na+]>[HS-]>[S2-]>[OH-]
C.[Na+]=[S2-]+[HS-]+[H2S] D.[HS-]>[H+]>[OH-]>[Na+]
[点晴] A。
[点题]25℃时,向1mLpH=a的盐酸中滴加10mL pH=b的NaOH溶液,当溶液中
n(Cl-=n(Na+)时,则a+b的值为
A.13 B.14 C.15 D.不能确定
[点晴] A
11、判断离子方程式的正误(近10年来的化学高考命题中的呈现率:100%)
[点题]下列离子方程式正确的是
A.向碘化亚铁溶液中通入少量氯气 2Fe2++Cl2=2Fe3++2Cl-
B.向次氯酸钙溶液中通入过量二氧化硫 Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
C.向硫酸氢钠溶液中滴入氢氧化钠溶液至中性 H++SO +Ba2++OH-=BaSO4↓+H2O
+Ba2++OH-=BaSO4↓+H2O
D.将氢氧化铁粉末加入氢碘酸中 Fe(OH)3+3H=Fe3++3H2O
[点晴] 离子方程式的书写易错点有1.拆与不拆 2.是否符合事实 3.局部约分 4.量的关系,书写或判断时应特别注意这几点。正确答案:均错。对A、B两选项的判断需要运用知识迁移能力,将FeI2与FeBr2联系,将SO2与CO2联系,同学们的漏洞在于易在迁移时注重相同点,忽略差异,思维定势严重,溴化亚铁中Fe2+还原性>Br-,所以少量Cl2只能将Fe2+氧化,Br-不参加反应,而FeI2中I-还原性>Fe2+,首先被氧化的是I-,Fe2+不参加反应,若忽视差异照猫画虎,必然出错,同理,SO2与CO2的区别在于SO2具有较强的还原性,易被次氯酸盐氧化,因此该反应是氧化还原反应而非简单的复分解。C选项中同学们易忽略量的关系,审题时应注意“至中性”这一限定条件,以H+与OH-的中和反应做为主要矛盾加以考虑,而不要将两个离子反应简单相加。D选项中同学们容易忽Fe3+能将I-氧化所以二者不能共存的事实,简单地将题意理解成氢碘酸作为强酸能将Fe(OH)3溶解。正确答案: A.2I-+Cl2=I2+Cl2 B.Ca2++2ClO-+H2O+SO2=CaSO4↓+H++Cl-+HClO
C.2H++SO +Ba2++2OH-=BaSO4↓+2H2O D.2Fe(OH)3+6H++2I-=2Fe2++I2+6H2O
+Ba2++2OH-=BaSO4↓+2H2O D.2Fe(OH)3+6H++2I-=2Fe2++I2+6H2O
10、离子的鉴别(近10年来的化学高考命题中的呈现率:80%)
[点题]某溶液中有NH4+、Mg2+、Fe2+和Al3+四种离子,若向其中加入过量的NaOH溶液,微热并搅拌,再加入过量的盐酸,溶液中大量减少的阳离子是 A、NH4+ B、Mg2+ C、Fe2+ D、Al3+ [点晴] 错误解答:选A。由于NH4+与OH-作用生成一水合氨,一水合氨在加热条件下分解释放出氨气,因此离子浓度将减小。错误原因:因不能掌握Fe(OH)2的强还原性而漏选。正确解答:本题不仅NH4+离子会减少(原因见“错误解答”),而且,当往溶液中加入氢氧化钠时,Fe2+会生成Fe(OH)2沉淀。Fe(OH)2具有具有强还原性,容易被空气中的氧气所氧化,转化为Fe(OH)3(题目具备氧化的条件),再加盐酸时,溶解为Fe3+。因此Fe3+也会大量减少。本题正确选项为A、C。
9、离子共存(近10年来的化学高考命题中的呈现率:100%)
[点题]下列各种溶液中,能大量共存的无色透明的离子组
A.使PH=0的溶液: Fe2+ 、NO3-、SO42-、I-
B.C(H+)=10-14mol· L-1的溶液中:Na+ 、AlO2-、S2-、SO32-
C.酸性环境下:Na+ 、 Cu2+ 、NO3-、SO42-、
D.使紫色石蕊试液变红的溶液中:K+ 、Na+ 、Ca2+ 、HCO3-
[点晴] 首先要看题目要求离子共存还是不共存,二看题目的隐含的条件:酸性?碱性?有色?还是无色?三看是否发生离子反应或氧化还原反应。选项A:NO3-在PH=0的溶液酸性中会氧化Fe2+成Fe3+, 选项C虽共存但Cu2+ 有颜色。选项D使紫色石蕊试液变红的溶液中为酸性溶液,HCO3- 不能存在。故选B。
[点题]常温下,某溶液中由水电离产生的c[H+]、C(OH-)满足c(H+)·c(OH+)=10-24,则下各
离子在该溶液中一定可以大量共存的是
A.K+ Na+ AlO2- Cl- B.Na+ Cl- SO42- HCO3-
C.NH4+ Na+ NO3- SO42- D.Ba2+ Na+ Cl- NO3-
[点晴] D
8、原子量、分子量,化合价(近10年来的化学高考命题中的呈现率:80%)
[点题]某元素R硝酸盐的相对分子质量为m,该元素相同价态的硫酸盐的相对分子质量为n,则该元素的可能化合价是 A、(m-n)/14 B、(n-m)/14 C、(2m-n)/28 D、(n-2m)/28 [点晴] 错误解答:假设该元素化合价为k,则硝酸盐化学式为R(NO3)k,硫酸盐化学式为R2(SO4)k。根据相对分子质量的概念,该元素的硝酸盐、硫酸盐的相对分子质量分别为R+62k、2R+96k,结合题目给出的两种分子的相对分子质量依次为m、n,可推知k值为(2m-n)/28,答案为C。错误原因:没有考虑该元素化合价为偶数的情况。当K为偶数时,硫酸盐的化学式应该是R(SO4)k/2。 正确解答:假设该元素化合价为k,若k为奇数,则硝酸盐化学式为R(NO3)k,硫酸盐的化学式为R2(SO4)k。根据相对分子质量的概念,该元素的硝酸盐、硫酸盐的相对分子质量分别为R+62k、2R+96k,结合题目给出的两种分子的相对分子质量依次为m、n,可推知k值为(2m-n)/28,答案为C;当k为偶数时,则硝酸盐的化学式为R(NO3)k,硫酸盐的化学式为R(SO4)k/2。根据相对分子质量的概念,该元素的硝酸盐、硫酸盐的相对分子质量分别为R+62k、R+48k,结合题目给出的两种分子的相对分子质量依次为m、n,可推知k值为(m-n)/14,答案为A。故选AC。
[点题]用足量的CO还原32.0 g某种氧化物,将生成的气体通入足量澄清石灰水中,得到60 g沉淀,则该氧化物是
A FeO B Fe2O3 C CuO D Cu2O
[点晴] 解题时,关键是要运用化学的学科思想抓住变化过程的某个方面,分析清楚,就能形成解题思路,找到解法。守恒原理(守恒原理的内容非常丰富,如氧化还原中的“电子得失守恒”、溶液中的“电荷守恒”、变化过程中的“某元素守恒”,还有质量守恒、体积守恒等等。)、差量原理、平均值的原理、整体思维、十字交叉法、等效原理、极限思维等,往往是“巧思妙解”的基础。
思路一:根据氧化物与二氧化碳的质量比来求解。
根据题意,可知 m(CO2)= 0.6mol 则m(氧化物):m(CO2)=32.0:26.4=1.21:1

 A FeO CO2 72:44=1.64:1
B Fe2O3 3CO2 160:132=1.21:1
A FeO CO2 72:44=1.64:1
B Fe2O3 3CO2 160:132=1.21:1

 C CuO CO2 80:44=1.82:1
D Cu2O CO2 144:44=3.27:1
C CuO CO2 80:44=1.82:1
D Cu2O CO2 144:44=3.27:1
故选B。
思路二:根据氧化物中氧的质量分数来求。
根据题意,可知0.6molCO2 比0.6molCO多了0.6mol的氧原子(9.6g),是CO从氧化物里夺取的,所以氧化物中氧的质量分数为9.6/32.0=0.30. 在四个选项中,只有B。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com