
题目列表(包括答案和解析)
20.(10分)已知A-L所代表的物质(溶液中的溶质),除B外均是中学化学里常见的物质,它们的转化关系如图所示。(反应时加入或生成水均略去)
已知:a.通常状况下,A是淡黄色固体,C是红棕色固体,D是气体单质,E是无色无味气体;b.反应②-③是工业生产L的部分反应,反应④是工业生产普通玻璃的反应之一;c.B是由两种元素组成的化合物,其质量比为7:5;请填写下列空白:

(1)A的电子式 ,B的化学式 。
(2)反应②的工业生产条件 ,写出工业生产L时反应①的设备名称 。
(3)完成下列反应方程式:
①I+G→M+L的离子方程式: ,
②反应④的化学方程式: 。
19. (8分)原子序数依次增大的A、B、C、D四种短周期元素。元素A的原子半径在短周期中最小,元素C的单质在空气中含量最多,D所在周期的各元素单质沸点变化如图I(原子序数按递增顺序连续排列)。B、C、D三种元素均能与A形成等电子的三种分子,且化合物中各原子的个数比为:
(8分)原子序数依次增大的A、B、C、D四种短周期元素。元素A的原子半径在短周期中最小,元素C的单质在空气中含量最多,D所在周期的各元素单质沸点变化如图I(原子序数按递增顺序连续排列)。B、C、D三种元素均能与A形成等电子的三种分子,且化合物中各原子的个数比为:
|
化合物 |
甲 |
乙 |
丙 |
|
原子个数比 |
B∶A=1∶3 |
C∶A=1∶2 |
D∶A=1∶2 |
(1)元素D在元素周期中的位置 。
(2)B、C形成的一种化合物X是一种原子晶体,晶体中B、C原子均达到稳定结构,则X的化学式为 ;X的熔点 金刚石(填“大于”、“等于”或“小于”)。
(3)写出图I中沸点最高的单质与NaOH溶液反应的离子方程式 。
18.(12分)实验室需要制备纯净的氯化钾。现有含少量KBr和K2SO4的氯化钾样品,按照下图所示的实验方案进行提纯。

请回答下列问题:
(1)操作I的名称为 ,操作II所需要的玻璃仪器有 。
(2)若用硝酸钡来代替氯化钡,是否可行?请说明理由。
。
(3)若实验所得固体甲、乙的质量分别为W 1g和W 2g,则样品中KBr的质量分数计算式为 。
(4)某同学对该实验方案提出质疑,他认为加适量氯化钡溶液不容易控制,应该加入过量氯化钡溶液,请你按照他的思路,用上述实验流程图表示出他后面的实验过程,要注明所用试剂和所得产物的化学式以及相应操作的名称。
17.(10分)为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
(1)定性分析:如图甲可通过观察 ,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3 更为合理,其理由是 。写出H2O2在二氧化锰作用下发生反应的化学方程式 。

(2)定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。图中仪器A的名称为 ,检查该装置气密性的方法是
,实验中需要测量的数据是 。
16. 如图,容器A左侧是可平行移动的活塞。向A中充入1molX的1molY,向B中充入2molX和2molY,起始时A、B的体积都等于a L。在相同温度、外界压强和催化剂存在的条件下,关闭活塞K,使两容器中各自反应:X (g)+ Y(g)
如图,容器A左侧是可平行移动的活塞。向A中充入1molX的1molY,向B中充入2molX和2molY,起始时A、B的体积都等于a L。在相同温度、外界压强和催化剂存在的条件下,关闭活塞K,使两容器中各自反应:X (g)+ Y(g)  Z(g)+2W(g)。达平衡时,A的体积为1.2 a L 。下列说法正确的是
Z(g)+2W(g)。达平衡时,A的体积为1.2 a L 。下列说法正确的是
A.反应速率:v(B) >v(A)
>v(A)
B.A容器中X的转化率为 20%
C.平衡时的压强:PB=2PA
D.若打开K,则达到新的化学平衡时,A的体积为2.6a L
第Ⅱ卷(非选择题 共86分)
15.下列各溶液中,微粒的物质的量浓度关系正确的是
A.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-)
B.在0.1mol·L-1Na2CO3溶液中:c(OH-)==c(HCO3-)+c(H+)+ c(H2CO3)
C.pH>7的NaCN与HCN的混合溶液中一定有:c(Na+)>c(CN-) >c(OH-) >c(H+)
D.pH>7的CH3COONa与NaOH的混合溶液中一定有:c(Na+)>c(CH3COO-) >c(OH-) >c(H+)
14.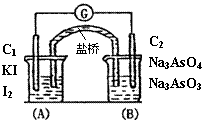 已知反应AsO43-+2I-+2H+
已知反应AsO43-+2I-+2H+  AsO33-+I2+H2O是可逆反应。设计如图装置(盐桥中的阴、阳离子可以自由移动,盐桥在原电池中不参与反应,只起导体作用),分别进行下述操作:(Ⅰ)向(B)烧杯中逐滴加入浓盐酸,(Ⅱ)向(B)烧杯中逐滴加入40%NaOH溶液。结果均发现电流计指针偏转。据此,下列判断正确的是
AsO33-+I2+H2O是可逆反应。设计如图装置(盐桥中的阴、阳离子可以自由移动,盐桥在原电池中不参与反应,只起导体作用),分别进行下述操作:(Ⅰ)向(B)烧杯中逐滴加入浓盐酸,(Ⅱ)向(B)烧杯中逐滴加入40%NaOH溶液。结果均发现电流计指针偏转。据此,下列判断正确的是
A.两次操作过程中指针偏转方向相同
B.两次操作过程中指针偏转方向相反
C.(Ⅰ)操作过程中C2棒上发生的反应为:AsO43-+2e-+2H+= AsO33-+H2O
D.(Ⅱ)操作过程中C1棒上发生的反应为:2I--2e- = I2
13.甲、乙、丙、丁为短周期元素形成的粒子,它们的电子总数相等。已知四种粒子中,甲、乙为分子,丙为双原子构成的负二价阴离子,丁为原子。则下列说法正确的是
A.丙与钙离子组成的化合物为离子化合物
B.丁原子一定是稀有气体原子
C.甲、乙的分子中可能有非极性分子
D.丙与钙离子组成的化合物和水反应生成的气体一定是乙炔
12.如图为某有机物的结构简式,每个节点处代表有一个碳原子,与其结合的氢原子的元素符号省略,这种化学式称为“键线式”。又知酯类在铜铬氧化物(CuO·CuCrO4)催化下,与氢气反应得到醇,羰基双键可同时被还原,但苯环在催化氢化过程中不变,其反应原理如下:


关于该化合物的下列说法中,正确的是
A.该有机物的化学式为C20H14O5
B.1mol该有机物与浓溴水反应,消耗5molBr2
C.与足量氢氧化钠溶液充分反应,所得产物中相对分子质量较小的钠盐为HCOONa
D.1mol该有机物在铜铬氧化物催化下能与2mol氢气发生反应
11.将一定体积的CO2通入V L NaOH溶液中,已知NaOH完全反应,若在反应后的溶液中加入足量石灰水,得到Ag沉淀;若在反应后的溶液中加入足量CaCl2溶液,得到Bg沉淀,则下列说法正确的是
A.标准状况下,参加反应的CO2体积为0.224AL
B.用上述数据不能确定NaOH溶液的物质的量浓度
C.若A=B,则CO2与NaOH溶液反应的产物只有Na2CO3
D.B可能等于A、小于A或大于A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com