
题目列表(包括答案和解析)
8.下列各组离子中,一定能大量共存的是:
A.加入铝粉有氢气产生的溶液中:Na+、SO3 、C1-、K+
、C1-、K+
B.PH = 0的溶液中:Na+、K+、Fe 2+、NO3-
C.在水电离产生的c(OH-)= 1×10-13溶液中:Ba2+、NO3-、ClO-、Ca2+
D.在c(H+)/c(OH-)= 1×1013的溶液中:NH4+、Ca2+、C1-、K+
7.下列指定微粒数目不是1 : 1的是
A.Na2O2晶体中的阳离子和阴离子 B.NaHCO3晶体中的阳离子和阴离子
C. Mg2+离子中的质子和中子 D.醋酸钠溶液中的阳离子总数与阴离子总数
Mg2+离子中的质子和中子 D.醋酸钠溶液中的阳离子总数与阴离子总数
6.引起下列环境污染的原因不正确的是
A.重金属、农药和难分解有机物等会造成水体污染
B.SO2、NO2或CO2都会导致酸雨的形成
C.装饰材料中的甲醛、芳香烃及氡等会造成居室污染
D.CO2和氟氯烃等物质的大量排放会造成温室效应的加剧
28.(15分)
 t℃ 时,将2 mol SO2和1 mol O2通入体积为2 L的恒温恒容密闭容器中,发生如下反应:2SO2 ( g ) +O2 ( g ) 2 SO3
(g ),ΔH = -196.6 kJ/mol。2min时反应达到化学平衡,此时测得反应物O2 还剩余0.8 mo1。请填写下列空白:
t℃ 时,将2 mol SO2和1 mol O2通入体积为2 L的恒温恒容密闭容器中,发生如下反应:2SO2 ( g ) +O2 ( g ) 2 SO3
(g ),ΔH = -196.6 kJ/mol。2min时反应达到化学平衡,此时测得反应物O2 还剩余0.8 mo1。请填写下列空白:
(1)从反应开始至达到化学平衡,生成SO3平均反应速率为_____________;平衡时SO2转化率为__________________。
(2)下列叙述能证明该反应已经达到化学平衡状态的是(填标号,下同)__________
A.容器内压强不再发生变化
B.SO2的体积分数不再发生变化
C.容器内气体原子总数不再发生变化
D.相同时间内消耗2n mol SO2的同时消耗n mol O2
E.相同时间内消耗2n molSO2的同时生成n mol O2
(3)反应达到化学平衡后,以下操作将引起平衡向正反应方向移动并能提高SO2转化率的是_________________
A.向容器中通人少量O2 B.向容器中通入少量SO2
C.使用催化剂 D.降低温度
E.向容器中通入少量氦气(已知氦气和SO2、O2、SO3都不发生反应)
(4)t℃时,若将物质的量之比n(SO2):n(O2)= 1:1的混合气体通入一个恒温恒压的密闭容器中,反应达到化学平衡时,混合气体体积减少了20 %。SO2的转化率为________。
27. (15分)短周期元素a、b、c、d的原子序数依次增大,
(15分)短周期元素a、b、c、d的原子序数依次增大,
它们分属于不同主族,这四种元素的原子电子层数之和
为8。A、B、C、D依次是a、b、c、d的单质,在一定
条件下可以发生如图所示的化合反应:
甲、乙、丙分子内原子数依次为4、3、2。
(1)将甲和丙两气体混合后产生白烟,则丁的化
学式是___________,若将甲通入乙中所得
溶液pH 大于7,则乙的化学式是_______________。
(2)甲、乙、丙三分子中,电子数相同的是_____________(填化学式);甲与乙等物质的量化合而成戊,戊的化学式为_____________。
(3)高温时,甲与C在催化剂作用下加热可以发生反应。该反应是工业生产某强酸的重要
环节,此反应的化学方程式为________________________________________
(4)甲+D --→丁+B,写出该反应的化学方程式______________________
(5)若甲溶液和溶液的pH之和等于14,两溶液等体积混合.所得溶液pH_______7(填“>”或“<”或“=”)。
(6)写出一种由a、b、c、d四种元素组成的化合物的化学式________________,该化合物构成的晶体是___________________晶体(填晶体类型)。
26.(15分)某校化学课外活动小组为探究氮的化合物的性质,设计了如下图所示实验。A处是气体发生装置,A中所用实验药品从下列物质中选取:
 ①Na2CO3 ②NaHCO3 ③NH4HCO3 ④NH4Cl ⑤Ca(OH)2 ⑥浓氨水 ⑦NaOH
①Na2CO3 ②NaHCO3 ③NH4HCO3 ④NH4Cl ⑤Ca(OH)2 ⑥浓氨水 ⑦NaOH
按上图连势头好各仪器,先将C处Pt丝网加热至红热,再将A处产生的气体通过B装置片刻后撤去C处酒精灯。部分实验现象如下:Pt丝继续保持红热,D中Cu片慢慢溶解。回答下列问题:
(1)若A中制取气体时只用一种药品,该药品为 (填前述备选药品的序号),则制取气体所用到的玻璃仪器有 。
(2)B装置的作用为 。
(3)写出C中发生反应的化学方程式 。
(4)D中Cu片发生反应的离子方程式为 。为了使Cu片溶解的速度明显加快,可向D处的溶液中加入下列物质中的 (填下列各项序号)。
a.Na2CO3 b.AgNO3 c.CuSO4 d.FeSO4
(5)有人认为他们设计的这套实验装置还存在明显的不足,对其不足之处以及应如何改进谈谈你的意见: 。
25.已知一个碳原子上连有两个羟基时,易脱水形成碳氧双键。请根据下图回答。
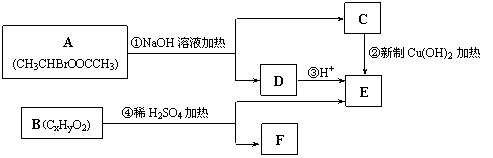
(1) E中含有的官能团的名称是_____________,反应②的反应类型是________________,
C跟新制的氢氧化铜反应的化学方程式为 。
(2) 已知B的相对分子质量为162,其燃烧产物中n(CO2)∶n(H2O)=2∶1。则B的分子式为
______________,F的分子式为______________。
(3) 在电脑芯片生产领域,高分子光阻剂是光刻蚀0.11 μm线宽芯片的关键技术。F是这种高分子光阻剂生产中的主要原料。F具有如下特点:①能跟FeCl3溶液发生显色反应;②能发生加聚反应;③芳环上的一氯代物只有两种。F在一定条件下发生加聚反应的化学方程
式为 。
(4)化合物G是F的同分异构体,它属于芳香族化合物,能发生银镜反应。G可能有________
种结构,写出其中任一种同分异构体的结构简式________________。
11.常温下,0.1mol·L-1某一元酸(HA)溶液中c(OH-)/c(H+)=1×10-8,下列叙述正确的是
A.该溶液中由水电离出的c(H+)=1×10-11 mol·L-1
B.由pH=3的HA与pH=11的NaOH溶液等体积混合,溶液中
c(Na+)>c(A-)>c(OH―)>c(H+)
C.浓度均为0.1mol/L的HA和NaA溶液等体积混合后,若溶液呈酸性,则
c(A-)>c(HA)>c(Na+)>c(H+)>c(OH-)
D.0.1mol·L-1HA溶液与0.05mol·L-1NaOH溶液等体积混合后所得溶液中
2c(H+)+c(HA)=c(A-)+c(OH-)
|
的硫酸试剂标签上的部分内容。据此下列
说法正确的是 ( )
A.该试剂的物质的量浓度9.2mol·L-1
B.该硫酸50mL与足量的铜反应,被氧
化的铜的物质的量为0.46mol
C.配制250mL4.6mol·L-1的稀硫酸需取
该硫酸62.5mL
D.该硫酸与等体积的水混合所得溶液的质
量分数小于49%
10.下列离子方程式的书写中,正确的是 ( )

A.电解饱和食盐水:2Cl-+ 2H+ H2↑+ Cl2↑
 B.碳酸钠溶液与醋酸溶液混合:CO32- + 2H+ CO2↑+ H2O
B.碳酸钠溶液与醋酸溶液混合:CO32- + 2H+ CO2↑+ H2O
 C.氢氧化亚铁与稀硝酸混合:Fe(OH)2
+ 2H+ Fe2+
+ 2H2O
C.氢氧化亚铁与稀硝酸混合:Fe(OH)2
+ 2H+ Fe2+
+ 2H2O
 D. 铜片插入三氯化铁溶液中:Cu + 2Fe3+ Cu2+
+ 2Fe2+
D. 铜片插入三氯化铁溶液中:Cu + 2Fe3+ Cu2+
+ 2Fe2+
9. 尼泊金甲酯常用作化妆品防腐剂,其结构简式为
尼泊金甲酯常用作化妆品防腐剂,其结构简式为
下列关于尼泊金甲酯的叙述,错误的是 ( )
A.分子式是C8H8O3
B.分子内所有的原子可能都在同一平面上
C.和NaOH溶液反应,1mol尼泊金甲酯消耗2mol NaOH
D.尼泊金甲酯的同分异构体中,苯环直接连着羟基和羧基的有10种
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com