
题目列表(包括答案和解析)
21.(8分)已知①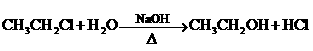
②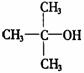 不能氧化为醛或羧酸.
不能氧化为醛或羧酸.
PMAA是一种“智能型”大分子,可应用于生物制药中大分子和小分子的分离.下列是以A物质为起始反应物合成PMAA的路线:
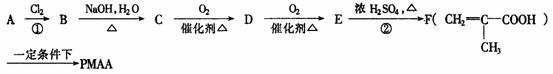
(1)分别写出A和PMAA的结构简式A________________________;PMAA________________________.
(2)上述反应过程中①②的反应类型分别是①______________________________;②______________.
(3)写出E→F的化学方程式_______________________________________________________________.
20.(10分)如图中A至L分别表示反应中的一种常见物质,E、F、I在通常情况下是气体单质,其中E有刺激性气体,X、Y是常见的金属单质.W是由甲、乙两种元素按1∶1组成,其中甲元素的原子M层电子数是K层的一半.乙元素的原子最外层电子数是次外层电子数的3倍,参加反应的水和生成的水已从图中略去.
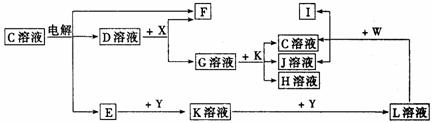
填写下列空白:
(1)E是________________________(化学式),Y元素在周期表中的位置是________________________.
(2)用电子式表示W的形成过程__________________________________________________________.
(3)写出K+G→H+J+C的离子方程式______________________________________________________.
(4)设计实验分离H和J(写出加入试剂和操作方法):______________________________________.
19.(10分)现有某金属的硝酸盐2.160g,充分加热分解生成金属氧化物0.960g和 、
、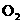 的混合气体0.0270mol(不考虑
的混合气体0.0270mol(不考虑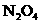 ).请填空:
).请填空:
(1)混合气体中 的物质的量为________________________mol.
的物质的量为________________________mol.
(2)将此组成的混合气体通入足量水中,剩余气体在标准状况下体积为________________________mL.
(3)该反应中金属元素的化合价________________________(填升高、降低、不变).
(4)写出该硝酸盐分解的化学方程式,标明电子转移的方向和数目.
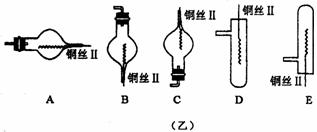
18.(10分)图(甲)是实验室用氢气还原氧化铜实验的微型快速实验装置.其中的粗铜丝“Ⅰ”可以在试管M中上下移动,实验前先将铜丝“Ⅰ”处理成下端弯曲的一小圆环,并用铁锤击成带小孔的小匙,虚线框中需连入图(乙)(仪器上下端位置固定)的某装置进行实验.图乙中的细铜丝“Ⅱ”一端被弯成螺旋状.
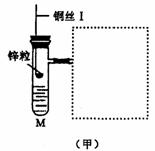
(1)在图甲中,试管M中的液体应选用__________ _____________________.
(2)在图示的虚线框中应连入的最合适的装置是___ _____(填代号)
(3)上述制氢气的方法与将锌粒直接加入试管中相比,其优点有________________________________
_________________________________________________________________________________________.
(4)实验过程中,在试管M中可观察到的现象是_____________________________________________
_____________________________________________________________________________________________
(5)实验时,细铜丝“Ⅱ”的操作方法是____________________________________________________
_____________________________________________________________________________________________
(6)若实验室无粗铜丝,而改用无锈粗铁丝,为让其反复使用,则此时M中的液体为________;发生反应的离子方程式为______________________________________________________________________________.
17.(8分)在120℃,101.3kPa条件,有2L 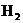 、2L
CO、1L
、2L
CO、1L 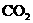 、0.5L
、0.5L
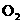 和1L
和1L 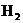 组成的混合气体.将混合气体通过分别放有足量Cu粉、C粉和CuO粉的三个灼热的反应管.假设气体通过每个反应管都能充分反应,且不论三个反应管以何种顺序排列,问:
组成的混合气体.将混合气体通过分别放有足量Cu粉、C粉和CuO粉的三个灼热的反应管.假设气体通过每个反应管都能充分反应,且不论三个反应管以何种顺序排列,问:
(1)尾气是否有可能是单一气体________(填可能或不可能).若可能,该气体是________.
(2)原气体中是否有几种(或一种)不可能再存在于尾气之中________(填有或没有)若有,它们(或它)是______________________.
(3)原气体中是否有几种(或一种)肯定存在于尾气之中________(填有或没有)若有,它们(或它)是_____ ___.
16.以酚酞试液为指示剂,对某新制的NaOH溶液进行中和滴定实验.数据记录如下表:
|
项目 |
待测液 |
消耗标准盐酸 (0.1mol/L)的体积 |
|
① |
20mL NaOH溶液 |
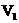 mL mL |
|
② |
20mL NaOH溶液+10mL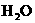 10mL 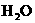 |
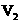 mL mL |
|
③ |
敞口隔夜放置的20mL NaOH溶液 |
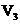 mL mL |
该新制的NaOH溶液的浓度c(NaOH)合理的是( )
A.c(NaOH)=0.10×(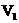 +
+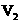 +
+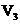 )/(3×20)mol·
)/(3×20)mol·
B.c(NaOH)=0.10×(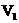 +
+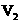 )/(2×20)mol·
)/(2×20)mol·
C.c(NaOH)=0.10×(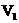 +
+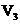 )/(2×20)mol·
)/(2×20)mol·
D.c(NaOH)=0.10×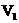 /20mol·
/20mol·
第Ⅱ卷(非选择题,共56分)
15.下列说法中正确的是( )
A.离子化合物中可能含有共价键 B.共价化合物一定形成原子晶体
C.金属元素在化合物中只能形成离子键 D.全部由非金属元素构成的化合物,一定为共价化合物
14.中学化学实验中常见的使用温度计如下三种情况:①温度计的液泡浸没在液体反应物液面以下并接近容器的底部;②温度计的液泡置于水浴中;③温度计的液泡置于蒸馏烧瓶的支管处.下列实验使用温度计正确的是( )
A.苯的硝化反应 ①
B.酒精和浓硫酸混合加热制乙烯 ①
C.测定硝酸钾在水中的溶解度 ③
D.分离苯和硝基苯的混合物 ②
13.在硫酸铝、硫酸钾和明矾的混合溶液中,如果 的离子浓度为0.2mol·
的离子浓度为0.2mol· ,当加入等体积0.2mol·
,当加入等体积0.2mol· KOH溶液时,生成的沉淀恰好完全溶解,则反应后混合溶液中
KOH溶液时,生成的沉淀恰好完全溶解,则反应后混合溶液中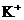 离子浓度约是( )
离子浓度约是( )
A.0.125mol· B.0.225mol·
B.0.225mol· C.0.250mol·
C.0.250mol· D.0.450mol·
D.0.450mol·
12.在复印室工作时会闻到一股特殊的气味,离复印机越近,该气味越浓.若用润湿的KI淀粉试纸接近该气体,则试纸会变蓝,则该物质的化学式是( )
A.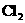 B.
B. C.
C.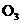 D.
D.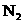
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com