
题目列表(包括答案和解析)
26.(2008年江苏)研究反应物的化学计量数与产物之间的关系时,使用类似数轴的方法可以收到的直观形象的效果。下列表达不正确的是
A.密闭容器中CuO和C高温反应的气体产物: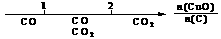
B.Fe在Cl2中的燃烧产物: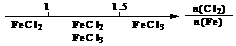
C.AlCl3溶液中滴加NaOH后铝的存在形式: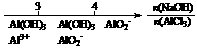
D.氨水与SO2反应后溶液中的铵盐: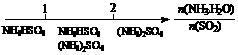
25.(2007年江苏(10分)钢铁工业是国家工业的基础。2006年我国粗钢产量突破4亿吨,居世界首位。
某中学社会实践活动小组利用假期对当地钢铁厂进行了调研,对从矿石开始到钢铁产出的工
艺流程有了全面的感性认识。请您对社会实践活动小组感兴趣的问题进行计算:
(1)将6.62 g铁矿石样品投入适量的盐酸中(充分反应),过滤,然后在滤液中加过量的NaOH 溶液,
充分反应后,过滤、洗涤、灼烧得4.80g Fe2O3。现以该铁矿石为原料炼铁,若生产过程中铁
元素损失4%,计算每生产1.00t生铁(含铁96%),至少需要这种铁矿石多少吨?
(保留两位小数)
(2)取某钢样粉末28.12g(假设只含Fe和C),在氧气流中充分反应,得到CO2气体224mL(标准状况)。
① 计算此钢样粉术中铁和碳的物质的量之比。
②再取三份不同质量的钢样粉末 分别加到100mL相通浓度的H2SO4溶液中,充分反 应后,
测得的实验数据如下表所示:
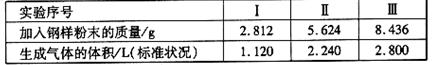
计算硫酸溶液的物质的量浓度。
③若在实验Ⅱ中继续加入mg钢样粉末,计算反应结束后剩余的固体质量为多少?
(用含m的代数式表示)
24.(2007年江苏(8分)在隔绝空气的条件下,某同学将一块部分被氧化的钠块用一张已除氧化膜、并用针刺
一些小孔的铝箔包好,然后放入盛满水且倒置于水槽中的容器内。待钠块反应完全后,在容器
中仅收集到1.12 L氢气(标准状况),此时测得铝箔质量比反应前减少了0.27g,水槽和容器内
溶液的总体积为2.0 L,溶液中NaOH的浓度为0.050mol·L-1
(忽略溶液中离子的水解和溶解的氢气的量)。
(1)写出该实验中发生反应的化学方程式。
(2)试通过计算确定该钠块中钠元素的质量分数。
23.(2007年江苏(10分)实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:
4NH4++6HCHO=3H++6H2O+(CH2)6N4H+ [滴定时,1 mol(CH2)6N4H+与 l mol H+相当],
然后用NaOH标准溶液滴定反应生成的酸,某兴趣小组用甲醛法进行了如下实验:
步骤I 称取样品1.500g。
步骤II 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤Ⅲ 移取25.00mL样品溶液于250mL锥形瓶中,加入10mL20%的中性甲醛溶液,摇匀、静置
5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。
按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数
(填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积
(填“偏大”、“偏小”或“无影响”)
③滴定时边滴边摇动锥形瓶,眼睛应观察
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由 色变成 色。
(2)滴定结果如下表所示:
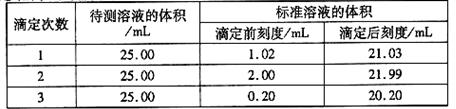
若NaOH标准溶液的浓度为0.1010mol·L-1则该样品中氮的质量分数为
22、(2007年天津)取0.1000 g样品在空气中充分灼烧,将生成的SO2气体与足量‘Fe2(SO4)3溶液完全反应后,用浓度为0.02000 mol/L的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00 mL 。
已知:SO2 + 2Fe3+ + 2H2O == SO2- + 2Fe2+ + 4H+
Cr2O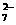 + 6 Fe2+
+ 14 H+ == 2 Cr3+
+ 6 Fe3+
+ 7 H2O
+ 6 Fe2+
+ 14 H+ == 2 Cr3+
+ 6 Fe3+
+ 7 H2O
⑴.样品中FeS2的质量分数是(假设杂质不参加反应)________________。
⑵.若灼烧6 g FeS2产生的SO2全部转化为SO3气体时放出9.83 kJ热量,产生的SO3与水全部化合生成H2SO4 ,放出13.03 kJ热量,写出SO3气体转化为H2SO4的热化学方程式:______________________________________________________________________。
⑶.煅烧10 t上述黄铁矿,理论上产生SO2的体积(标准状况)为_______________L,制得98%的硫酸质量为__________ t ,SO2全部转化为H2SO4时放出的热量是_______ kJ。
21.(2006年广东卷) (14分) 钴(Co)化合物对化学键的研究起着重要的作用。为测定某钴化合物[Co(NH3)xCly]Clz的组成,进行如下实验:
... ①称取样品0.5010g,加入过量的NaOH溶液,煮沸,蒸出所有的氨,冷却,得到A。产生的氨用50.00mL0.5000mol·L-1的盐酸完全吸收并用蒸馏水定容至100mL,得溶液B。取B溶液20.00mL, 用0.1000mol·L-1NaOH滴定,消耗NaOH溶液30.00mL。
... ②向A中加入过量KI固体,振荡,盐酸酸化后置于暗处,发生反应:
Com++I-→Co2++I2 (未配平)
反应完成后,蒸馏水稀释,用Na2S2O3溶液滴定析出的I2,消耗0.1000mol·L-1Na2S2O3溶液20.00mL。反应方程式为:I2+2Na2S2O3==2NaI+Na2S4O6
③另称取该物质样品0.2505g,溶于水,以0.1000mol·L-1AgNO3溶液滴定至恰好反应完全,消耗AgNO3溶液20.00mL。相应反应式为:
[Co(NH3)xCly]Clz+zAgNO3==[Co(NH3)xCly](NO3)z+zAgCl↓
通过计算求:
⑴[Co(NH3)xCly]Clz中氮元素的质量分数。
⑵该钴化合物的化学式。
20、(2005年上海)过氧化钙是一种安全无毒的物质,带有数量不等的结晶水,通常还含有部分CaO。
(1)称取0.542g过氧化钙样品,灼热时发生如下反应:
2CaO2·XH2O 2CaO + O2↑ + 2XH2O,得到的O2在标准状况下体积为67.2mL,该样品中CaO2的物质的量为 。
(2)另取同一样品0.542g,溶于适量的稀盐酸中,然后加入足量的Na2CO3溶液,将溶液中Ca2+全部转化为CaCO3沉淀,得到干燥的CaCO3 0.70g。
① 试计算样品中CaO的质量。
② 试计算样品中CaO2·XH2O的X值。
19.(2005年广东)(14分)化合物KxFe(C2O4)y·z H2O是一种重要的光化学试剂,其中铁为+3价。分别称取该样品0.491g两份,其中一份在110℃干燥脱水,至质量恒定为0.437g。另一份置于锥形瓶中,加入足量的3mol/LH2SO4和适量的蒸馏水,加热到75℃,趁热加入0.0500mol/L KMnO4溶液24.0mL,恰好完全反应;再向溶液中加入适量的某种还原剂,将Fe3+完全转化为Fe2+,该溶液中Fe2+刚好与4.0mL 0.0500mol/L KMnO4溶液完全反应。
通过计算,分别求:
⑴ 0.491g样品中结晶水的物质的量。
⑵ 化合物中草酸根的质量分数。
⑶ 化合物的化学式。
已知:2KMnO4 + 5H2C2O4 + 3H2SO4 == 2MnSO4 + K2SO4 + 10CO2↑+ 8H2O
MnO4- + 5Fe2+ + 8H+ == Mn2+ + 5Fe3+ + 4H2O
18.(16分)(2004全国) O
‖
抗击“非典”期间,过氧乙酸(CH3C-O-OH)是广为使用的消毒剂。它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2。测定产品中过氧乙酸浓度c0。涉及下列反应:
 ① □MnO4+□H2O2+□H+
□Mn2++□O2十□H2O
① □MnO4+□H2O2+□H+
□Mn2++□O2十□H2O
 ② H2O2+2
② H2O2+2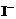 +2H+
I2+2H2O
+2H+
I2+2H2O
O
‖
 ③ CH3C-O-OH+2
③ CH3C-O-OH+2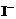 +2H+
CH3COOH+I2+H2O
+2H+
CH3COOH+I2+H2O
请回答以下问题:
(l)配平反应①的离子方程式(配平系数填人以下方框内):
 □MnO4+□H2O2+□H+
□Mn2++□O2十□H2O
□MnO4+□H2O2+□H+
□Mn2++□O2十□H2O
(2)用Na2S2O3标准溶液滴定I2时(反应④)选用的指示剂是____________________。
(3)取b0 mL待测液,用硫酸使溶液酸化,再用浓度为a1 mol·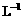 的KmnO4标准溶液
的KmnO4标准溶液
滴定其中的H2O2,耗用的KMnO4体积为b1 mL(反应①,滴定过程中KmnO4不
与过氧乙酸反应)。
另取b0 mL待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟 KI反应生成 I2(反应②和③)。再用浓度为a2 mol·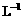 的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为b2 mL。
的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为b2 mL。
请根据上述实验数据计算过氧乙酸的浓度(用含a1、a2、b0、b1、b2的代数式表示)。
c0= ________________________。
(4)为计算待测液中过氧乙酸的浓度c0,加入的KI的质量已过量但没有准确称量,是
否影响测定结果 _______________(填是或否)
17.(08广东卷)相同质量的下列物质分别与等浓度的NaOH溶液反应,至体系中均无固体物质,消耗碱量最多的是( )
A.Al B.Al(OH)3 C.Al Cl3 D.Al2O3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com