
题目列表(包括答案和解析)
6、(2005年全国)已知充分燃烧a g乙炔气体时生成1mol 二氧化碳气体和液态水,并放出热量 b kJ,则乙炔燃烧的热化学方程式正确的是
A、2C2H2(g) + 5O2(g)====== 4CO2(g)+2H2O(l); ΔH = -4b kJ / mol
B、C2H2(g) + 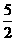 O2(g)======2CO2(g)+H2O(l);
ΔH = -4b kJ / mol
O2(g)======2CO2(g)+H2O(l);
ΔH = -4b kJ / mol
C、2C2H2(g) + 5O2(g)====== 4CO2(g)+2H2O(l); ΔH = -2b kJ / mol
D、2C2H2(g) + 5O2(g)====== 4CO2(g)+2H2O(l); ΔH = b kJ / mol
5.(2005年江苏)氢气(H2)、一氧化碳(CO)、辛烷(C8H18)、甲烷(CH4)的热化学方程式分别为:
H2(g) + 1/2O2(g) = H2O(l);△H= -285.8 kJ/mol
CO(g) + 1/2O2(g) = CO2(g);△H= -283.0 kJ/mol
C8H18(l) + 25/2O2(g) = 8CO2(g) + 9 H2O(l);△H= -5518 kJ/mol
CH4(g) + 2 O2(g) = CO2(g) + 2 H2O(l);△H= -890.3 kJ/mol
相同质量的H2、CO、C8H18、CH4完全燃烧时,放出热量最少的是
A.H2(g) B.CO(g) C.C8H18(l) D.CH4(g)
4.(2004年全国)已知25℃、101kPa下,石墨、金刚石燃烧的热化学方程式分别为( )
C(石墨) + O2(g) === CO2(g) △H = -393.51kJ ·mol-1
C(金刚石) + O2(g) === CO2(g) △H = -395.41kJ ·mol-1
据此判断,下列说法中正确的是
A.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的低
B.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的高
C.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的低
D.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的高
3.已知(l)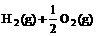 =H2O(g) △H1=a kJ·
=H2O(g) △H1=a kJ·
(2)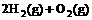 =2H2O(g) △H2=b kJ·
=2H2O(g) △H2=b kJ·
(3)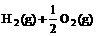 =H2O(l) △H3=c
kJ·
=H2O(l) △H3=c
kJ·
(4)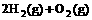 =2H2O(l) △H4=d kJ·
=2H2O(l) △H4=d kJ·
下列关系式中正确的是
A. a<c <0 B.b>d>0 C.2a=b<0 D.2c=d>0
2.(2004上海卷)实验室制取下列气体,其反应放热的是
A.由无水醋酸钠制CH4 B.由乙醇制C2H4
C.由电石制C2H2 D.由氯酸钾制O2
1.(2004年广东卷)已知葡萄糖的燃烧热是2804kJ/mol,当它氧化生成1g水时放出的热量是
A、26.0kJ B、51.9kJ C、155.8kJ D、467.3kJ
28.(本题共11分)
⑴0.012mol ⑵3.8 ⑶n(OH-):n(CO32-)=16:1 ⑷Al2Mg6(OH) 16CO2·4H2O
29解析:由于硬质玻璃管减少的质量为CuO中的氧的质量,所以n(CuO)==0.3mol,由方程式可知反应的CH4的物质的量为0.075mol。生成的CO2也为0.075mol,将气体通过澄清的石灰水生成8.5g沉淀,所以n(CO2)=0.085mol,原混合气体中的n(CO2)=0.01mol,而气体的总物质的量为:=0.09mol,所以n(N2)=0.005mol,N2的体积分数为:×100%=5.56%。
答案:(1)0.075mol。
(2)5.56%。
30解析:(1)2片小苏打所含NaHCO3的质量为1g,其物质的量为=0.012mol,
由HCO3-+H+===CO2↑+H2O,可知n(H+)=0.012mol。
(2)6片小苏打的物质的量为:=0036mol,即中和的H+为0.036mol,而每片的Al(OH)3的物质的量为=0.0031mol,由Al(OH)3+3H+ ===Al3++3H2O,所以Al(OH)3的片数为:=3.8片。
(3)①碱式盐中加入HCl,首先是碱式盐中的OH-和CO32-与H+反应生成H2O和HCO3-,所以n(HCO3-)=2.0mol·L-1×0.0025L=0.005mol,即n(CO32-)=0.005mol,H+与CO32-与HCl反应的H+的总物质的量为:2.0mol·L-1×0.0425L=0.085mol,所以n(OH-)=0.08mol,它们的物质的量之比为:16∶1。
②能与过量的NaOH溶液反应产生沉淀的只有Mg2+,所以n[Mg(OH)2]==0.03mol,若碱式盐中不含结晶水,则氢元素的质量分数为:0.08mol×1g/mol=0.08g,氢元素的质量分数为:=0.027<0.04,说明碱式盐中含有结晶水,根据题意有:m(Al)+m(H2O)+0.03mol×24g/mol+0.005mol×60g/mol+0.08mol×17g/mol=3.01g,=0.04,所以m(H2O)=0.36g,n(H2O)=002mol,m(Al)=0.27g,n(Al)=001mol,所以n(Al3+)∶n(Mg2+)∶n(OH-)∶n(CO32-)∶n(H2O)=0.01mol∶0.03mol∶0.08mol∶0.005mol∶0.02mol=2∶6∶16∶1∶4,即碱式盐的化学式为:Al2Mg6(OH)16CO3·4H2O。
答案:(1)0.012mol。
(2)3.8。
(3)n(OH-)∶n(CO32-)=16∶1。
(4)Al2Mg6(OH)16CO3·4H2O。
27.(本题共5分)
⑴0.075mol ⑵5.56%
26、B
22.(14分)⑴.90.00% ⑵.SO3(g) + H2O⑴ == H2SO4⑴;△H == -130.3 kJ/mol (2分)⑶.3.36 × 106 15 .43×107
23答案:(1)①偏高②无影响③B④无 粉红(或浅红)(2)18.85%


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com