
题目列表(包括答案和解析)
3、(2005年全国)高压电机、复印机工作时会产生臭氧,该气体有强氧化性。下列叙述中不正确的是
A 臭氧和氧气是氧的同素异形体 B 臭氧可使湿润的KI淀粉试纸变蓝
C 臭氧的存在对人体有益无害 D 臭氧是很好的消毒剂和脱色剂
2.(2005年北京春)近期,北京大学的两位教授率先发现人体心肺血管中存在微量硫化氢,它对调节心血管功能具有重要作用。下列叙述正确的是
A.硫化氢分子很稳定,受热难分解
B.硫化氢分子中所有原子的最外电子层都达到8电子结构
C.将硫化氢通入溴水,溴水褪色
D.硫化氢是电解质,其电离方程式是H2S =2H ++ S 2-
1.(2004年江苏卷)下列关于浓硫酸的叙述正确的是
A.浓硫酸具有吸水性,因而能使蔗糖炭化
B.浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体
c.浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体
D.浓硫酸在常温下能够使铁、铝等金属钝化
17.(08上海卷)(A)如图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质压到甲针筒内,进行下表所列的不同实验(气体在同温同压下测定)。试回答下列问题:
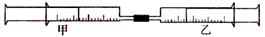
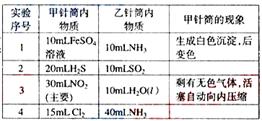
(1)实验1中,沉淀最终变为________色,写出沉淀变色的化学方程式_______________________________。
(2)实验2甲针筒内的现象是:有___________生成,活塞________移动(填向外、向内、不)。反应后甲针筒内有少量的残留气体,正确的处理方法是将其通入___________溶液中。
(3)实验3中,甲中的3mL气体是NO2和N2O4的混合气体,那么甲中最后剩余的无色气体是_______,写出NO2与H2O反应的化学方程式为_______________________________。
(4)实验4中,已知:3Cl2+2NH3 N2+6HCl。甲针筒出活塞有移动,针筒内有白烟产生外,气体的颜色变为____________。最后针筒内剩余气体的体积约为________mL。
N2+6HCl。甲针筒出活塞有移动,针筒内有白烟产生外,气体的颜色变为____________。最后针筒内剩余气体的体积约为________mL。
16、(2008年广东卷)(11分)
某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为1.00 mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K,每次实验HNO3的用量为25.0 mL、大理石用量为10.00 g。
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
|
实验编号 |
T/K |
大理石规格 |
HNO3浓度/mol·L-1 |
实验目的 |
|
① |
298 |
粗颗粒 |
2.00 |
(Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和 探究温度对该反应速率的影响; (Ⅲ)实验①和 探究大理石规格(粗、细)对该反应速率的影响;) |
|
② |
|
|
|
|
|
③ |
|
|
|
|
|
④ |
|
|
|
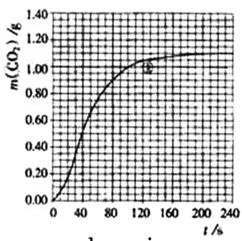
(2)实验①中CO2质量随时间变化的关系见下图:
依据反应方程式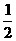 CaCO3+HNO3=
CaCO3+HNO3=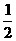 Ca(NO3)2+
Ca(NO3)2+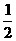 CO2↑+
CO2↑+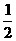 H2O,计算实验①在70-90 s范围内HNO3的平均反应速率(忽略溶液体积变化,写出计算过程)。
H2O,计算实验①在70-90 s范围内HNO3的平均反应速率(忽略溶液体积变化,写出计算过程)。
(3)请在答题卡的框图中,画出实验②、③和④中CO2质量随时间变化关系的预期结果示意图。
15、(2008年北京卷)(17分)X、Y、Z、W为含有相同电子数的分子或离子,均由原子序数小于10的元素组成。X有5个原子核。通常状况下,W为无色液体。
已知:X+Y Z+W
Z+W
⑴Y的电子式是 。
 ⑵液态Z与W的电离相似,都可电离出电子数相同的两种离子,液态Z的电离方程式是
。
⑵液态Z与W的电离相似,都可电离出电子数相同的两种离子,液态Z的电离方程式是
。
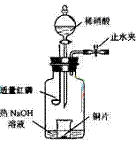
⑶用图示装置制备NO并验证其还原性。有下列主要操作:
a.向广口瓶内注入足量热NaOH溶液,将盛有铜片的小烧杯放入瓶中。
b.关闭止水夹,点燃红磷,伸入瓶中,塞好胶塞。
c.待红磷充分燃烧,一段时间后打开分液漏斗旋塞,向烧杯中滴入少量稀硝酸。
①步骤c后还缺少的一步主要操作是 。
②红磷充分燃烧的产物与NaOH溶液反应的离子方程式是 。
③步骤c滴入稀硝酸后烧杯中的现象是 。
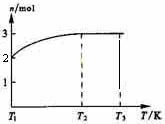 ⑷一定温度下,将1mol N2O4置于密闭容器中,保持压强不变,升高温度至T1的过程中,气体由无色逐渐变为红棕色。温度由T1继续升高到T2的过程中,气体逐渐变为无色。若保持T2,增大压强,气体逐渐变为红棕色。气体的物质的量n随温度T变化的关系如图所示。
⑷一定温度下,将1mol N2O4置于密闭容器中,保持压强不变,升高温度至T1的过程中,气体由无色逐渐变为红棕色。温度由T1继续升高到T2的过程中,气体逐渐变为无色。若保持T2,增大压强,气体逐渐变为红棕色。气体的物质的量n随温度T变化的关系如图所示。
①温度在T1~T2之间,反应的化学方程式是 。
②温度在T2~T3之间,气体的平均相对分子质量是(保留1位小数) 。
14.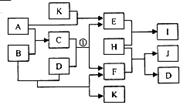 (2007年江苏(10分)右图中各物质均由常见元素(原子序数≤20)组成。
(2007年江苏(10分)右图中各物质均由常见元素(原子序数≤20)组成。
已知A、B、K为单质,且在常温下A和K为气体,B为固体。
D为常见的无色液体。I是一种常用的化肥,在其水溶液中滴
加AgNO3溶液有不溶于稀HNO3的白色沉淀产生。J是一种实验
室常用的干燥剂。它们的相互转化关系如右图所示
(图中反应条件未列出)。请回答下列问题:
(1)I的化学式为 ; J的电子式为
(2)反应①的化学方程式为
(3)F的水溶液与氯气反应的离子方程式为
13.(2006年上海卷)已知:4NH3+5O2 4NO+6H2O;4NO+3O2+2H2O
4NO+6H2O;4NO+3O2+2H2O 4HNO3
4HNO3
设空气中氧气的体积分数为0.20,氮气体积分数为0.80,请完成下列填空及计算:
(1)amol NO完全转化为HNO3需要氧气______mol;
(2)为使NH3恰好完全氧化为一氧化氮,氨-空气混合物中氨的体积分数为_______(保留2位小数)。
 (3)20.0moL的NH3用空气氧化,产生混合物的组成为:NO 18.0mol、O2 12.0mol、N2 150.0mol和一定量的硝酸,以及其它成分。(高温下NO和O2不反应)
(3)20.0moL的NH3用空气氧化,产生混合物的组成为:NO 18.0mol、O2 12.0mol、N2 150.0mol和一定量的硝酸,以及其它成分。(高温下NO和O2不反应)
计算氨转化为NO和HNO3的转化率。
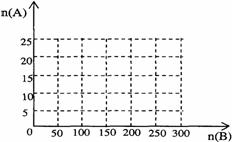
(4)20.0moL的NH3和一定量空气充分反应后,再转化为HNO3。
①在右图中画出HNO3的物质的量n(A)和空气的物质的量n(B)关系的理论曲线。
②写出当125≤n(B)≤200时,n(A)和n(B)的关系式_________________________。
12、 (2006年江苏卷)稀薄燃烧是指汽油在较大空/燃比(空气与燃油气的体积比)条件下的燃烧。随着全球能源危机的加剧,稀薄燃烧技术的研究受到了人们的重视,但稀薄燃烧时,常用的汽车尾气净化装置不能有效地将NOx转化为N2。不同空/燃比时汽车尾气中主要污染物的含量变化如右图所示。
(2006年江苏卷)稀薄燃烧是指汽油在较大空/燃比(空气与燃油气的体积比)条件下的燃烧。随着全球能源危机的加剧,稀薄燃烧技术的研究受到了人们的重视,但稀薄燃烧时,常用的汽车尾气净化装置不能有效地将NOx转化为N2。不同空/燃比时汽车尾气中主要污染物的含量变化如右图所示。
⑴稀薄燃烧技术除能节约能源外,还具有的优点是_______________(填一项)。排放到大气中的NOx会导致酸雨、_______________等环境问题(填一项)。
⑵某校化学研究性学习小组的同学在技术人员的指导下,按下列流程探究不同催化剂对NH3还原NO反应的催化性能。
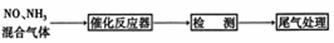
若控制其他实验条件均相同,在催化反应器中装载不同的催化剂,将经催化反应后的混合气体通入滴有酚酞的稀硫酸溶液(溶液的体积、浓度均相同)。为比较不同催化剂的催化性能,需要测量并记录的数据是______________。
⑶若某一催化剂能同时催化NH3等还原性气体与NOx的反应。将该催化剂分别用于催化还原含等物质的量NOx的两种气体:①纯NO气体,②汽车尾气。消耗NH3的物质的量较多的可能是_______________(填字母),原因是______________________________。
A.① B.② C.都有可能
10、(2006年江苏卷)下图是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件及生成的H2O已略去),已知:(a)A、B、C、D是非金属单质,其中B、C、D在常温常压下是气体。(b)反应①②是化工生产中的重要反应。(c)化合物E是形成酸雨的污染物之一,化合物K是常用的氮肥。(d)化合物L具有漂白性,可由Cl2与NaOH溶液反应而制得。(e)化合物J由两种元素组成,其相对分子质量为32。

请按要求填空:
⑴反应③的化学方程式__________________________________。
⑵C的结构式______________;H的化学式______________。
⑶L的溶液与化合物E反应的离子方程式______________。
⑷化合物J的化学式______________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com