
题目列表(包括答案和解析)
25. (2008年上海)(A)四种短周期元素的性质或结构信息如下表。氢根据信息回答下列问题。
|
元素 |
A |
B |
C |
D |
|
性质 结构 信息 |
室温下单质呈粉末状固体,加热易熔化。 单质在空气中燃烧,发出明亮的蓝紫色火焰。 |
单质常温、常压下是气体,能溶于水。 原子的M层有1个未成对的p电子。 |
单质质软、银白色固体、导电性强。 单质在空气中燃烧发出黄色的火焰。 |
原子最外层电子层上s电子数等于p电子数。 单质为空间网状晶体,具有很高的熔、沸点。 |
⑴B元素在周期表中的位置 ,写出A原子的电子排布式 。
⑵写出C单质与水反应的化学方程式 。
A与C形成的化合物溶于水后,溶液的pH 7(填“大于”、“等于”或“小于”)。
⑶D元素最高价氧化物晶体的硬度 (填“大于”、“小”),其理由是 。
⑷A、B两元素非金属性较强的是(写元素符号) 。写出证明这一结论的一个实验事实 。
24.(2008年四川)(15分)D、E、X、Y、Z是周期表中的前20号元素,且原子序数逐渐增大。它们的最简氢化物分子的空间构型依次是正四面体、三角锥形、正四面体、角形(V形)、直线形。回答下列问题:
(1)Y的最高价氧化物的化学式为__________;
(2)上述5种元素中,能形成酸性最强的含氧酸的元素是___________,写出该元素的任意3种含氧酸的化学式:___________________________________;
(3)D和Y形成的化合物,其分子的空间构型为____________;
(4)D 和X形成的化合物,其化学键类型属___________,其晶体类型属__________;
(5)金属镁和E的单质在高温下反应得到的产物是___________,此产物与水反应生成两种碱,该反应的化学方程式是____________________;
(6)试比较D和X的最高价氧化物熔点的高低并说明理由:
_______
23. (2008年北京卷)(13分)通常状况下,X、Y和Z是三种气态单质。X的组成元素是第三周期原子半径最小的元素(稀有气体元素除外);Y和Z均由元素R组成,反应Y+2I―+2H+ I2+Z+H2O常作为Y的鉴定反应。
I2+Z+H2O常作为Y的鉴定反应。
⑴Y与Z的关系是(选填字母) 。
a.同位素 b.同系物 c.同素异形体 d.同分异构体
⑵将Y和二氧化硫分别通入品红溶液,都能使品红褪色。简述用褪色的溶液区别二者的实验方法 。
⑶举出实例说明X的氧化性比硫单质的氧化性强(用化学方程式表示)。
。
⑷气体(CN)2与X化学性质相似,也能与H2反应生成HCN(其水溶液是一种酸)。
①HCN分子中含有4个共价键,其结构式是 。
②KCN溶液显碱性,原因是(用离子方程式表示) 。
⑸加热条件下,足量的Z与某金属M的盐MCR3(C为碳元素)完全反应生成CR2和MmRn(m、n均为正整数)。若CR2质量为w1g,MmRn质量为w2g,M的相对原子质量为a,则MmRn中m:n=
(用含w1、w2和a的代数式表示)。
22.(2008年海南)(8分)根据元素周期表1-20号元素的性质和递变规律,回答下列问题。
(1)属于金属元素的有________种,金属性最强的元素与氧反应生成的化合物有
___________(填两种化合物的化学式);
(2)属于稀有气体的是___________(填元素符号,下同);
(3)形成化合物种类最多的两种元素是____________________;
(4)第三周期中,原子半径最大的是(稀有气体除外)______________;
(5)推测Si、N最简单氢化物的稳定性_________大于_________(填化学式)。
21、(2008年天津)(14分)W、X、Y、Z是原子序数依次增大的同一短同期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物可以反应生盐和水,该反应的离子方程式为__。
(2)W与Y 可形成化合物W2Y,该化合物的电子式为__。
(3)X的硝酸盐水溶 液显__性,用离子方程式解释原因__。
(4)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为__。
(5)比较Y、Z气态氢化物的稳 定性__>__(用分子式表示)
(6)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是:
__>__>__>__。
(7)Z的最高价氧化物为无色液体,0.25 mol该物质与一定量水混合得到一种稀溶 液,并放出Q Kj的热量。写出该反应的热化学方程式:________。
20.(2008年全国Ⅱ)(15分)
Q、R、X、Y、Z为前20号元素中的五种,Q的低价氧化物与X单质分子的电子总数相等,R与Q同族,Y和Z的离子与Ar原子的电子结构相同且Y原子序数小于Z。.
(1)Q的最高价氧化物,其固态属于 晶体,俗名叫 :
(2)R的氢化物分子的空间构型是 ,属于 分子(填“极性”或“非极性”);它与X形成的化合物可作为一种重要的陶瓷材料,其化学式为 ;
(3)X的常见氢化物的空间构型是 ,它的另一氢化物X2H4是火箭燃料的成分,其电子式是 ;
(4)Q分别与Y、Z形成的共价化合物的化学式是 和 ;Q与Y形成的化合物的电子式为 ,属于 分子(填“极性”或“非极性”)。
19.(2008年宁夏)[化学--选修物质结构与性质](15分)
X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大。请回答下列问题:
(1)X、Y的元素符号依次为 、 ;
(2)XZ2与YZ2分子的立体结构分别是 和 ,相同条件下两者在水中的溶解度较大的是 (写分子式),理由是 ;
(3)Q的元素符号是 ,它属于第 周期,它的核外电子排布式为 ,在形成化合物时它的最高化合价为 ;
(4)用氢键表示式写出E的氢化物溶液中存在的所有氢键 。
18.(2008年江苏)(12分)
A.已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为 。
(2)B的氢化物的分子空间构型是 。其中心原子采取 杂化。
(3)写出化合物AC2的电子式 ;一种由B、C组成的化合物与AC2互为等电子体,其化学式为 。
(4)E的核外电子排布式是 ,ECl3形成的配合物的化学式为 。
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是 。
B.醇与氢卤酸反应是制备卤代烃的重要方法。实验室制备溴乙烷和1-溴丁烷的反应如下:
NaBr+H2SO4 HBr+NaHSO4
①
HBr+NaHSO4
①
R-OH+HBr R-Br+H2O
②
R-Br+H2O
②
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等。有关数据列表如下;
|
|
乙醇 |
溴乙烷 |
正丁醇 |
1-溴丁烷 |
|
密度/g·cm-3 |
0.7893 |
1.4604 |
0.8098 |
1.2758 |
|
沸点/℃ |
78.5 |
38.4 |
117.2 |
101.6 |
请回答下列问题:
(1)溴乙烷和1-溴丁烷的制备实验中,下列仪器最不可能用到的是 。(填字母)
a.圆底烧瓶 b.量筒 c.锥形瓶 d.布氏漏斗
(2)溴代烃的水溶性 (填“大于”、“等于”或“小于”);其原因是
。
(3)将1-溴丁烷粗产品置于分液漏斗中加水,振荡后静置,产物在 (填“上层”、“下层”或“不分层”)。
(4)制备操作中,加入的浓硫酸必需进行稀释,起目的是 。(填字母)
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(5)欲除去溴代烷中的少量杂质Br2,下列物质中最适合的是 。(填字母)
a.NaI b.NaOH c.NaHSO3 d.KCl
(6)在制备溴乙烷时,采用边反应边蒸出产物的方法,其有利于 ;但在制备1-溴丁烷时却不能边反应边蒸出产物,其原因是 。
17. (2007年江苏(8分)通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;
B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀。请回答:
(1)用化学符号表示下列4种微粒:
A: B : C: D : (2)写出A、B、E三种微粒反应的离子方程式:
、
16.(2007北京卷)(13分)短周期元素的单质X、Y、Z在通常状况下均为气态,并有下列转化关系(反应条件略去):

已知: a.常见双原子单质分子中,X分子含共价键最多。
b.甲分子中含10个电子,乙分子含有18个电子。
(1)X的电子式是 。
(2)实验室可用下图所示装置(缺少收集装置,夹持固定装置略去)制备并收集甲。
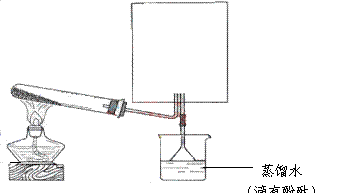

①在图中方框内绘出用烧瓶收集甲的仪器装置简图。
②试管中的试剂是(填写化学式) 。
③烧杯中溶液由无色变为红色,其原因是(用电离方程式表示)
。
(3)磷在Z中燃烧可生成两种产物,其中一种产物丁分子中各原子最外层不全是8电子结构,丁的化学式是 。
(4)n mol丁与n mol丙在一定条件下反应,生成4n mol乙和另一化合物,该化合物蒸气的密度是相同状况下氢气的174倍,其化学式是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com