
题目列表(包括答案和解析)
2.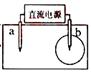 (08上海卷)取一张用饱和的NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现a电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色。则下列
(08上海卷)取一张用饱和的NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现a电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色。则下列
说法错误的是( )
A.b电极是阴极 B.a电极与电源的正极相连
C.电解过程中水是氧化剂 D.b电极附近溶液的pH变小
解析:a电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色,说明a极负极产生了Cl2,所以a极与电源的正极相连,即a为阳极,电极反应式为:2Cl--2e- ===Cl2↑,b为阴极,2H2O-4e- ===H2↑+2OH-,所以b极附近的pH增大。
答案:D
1.(08海南卷)关于铅蓄电池的说法正确的是( )
A.在放电时,正极发生的反应是 Pb(s) +SO42-(aq)= PbSO4(s) +2e-
B.在放电时,该电池的负极材料是铅板
C.在充电时,电池中硫酸的浓度不断变小
D.在充电时,阳极发生的反应是 PbSO4(s)+2e-= Pb(s)+ SO42-(aq)
解析:铅蓄电池的充放电反应为:Pb+PbO2+2H2SO4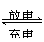
 PbSO4+2H2O,放电时Pb作负极:Pb-2e-+SO42- ===PbSO4,在正极上:PbO2+2e-+4H++SO42- ===PbSO4+2H2O;充电时,H2SO4的浓度不断增大,阳极上发生的是氧化反应,是失去电子而不是得到电子。
PbSO4+2H2O,放电时Pb作负极:Pb-2e-+SO42- ===PbSO4,在正极上:PbO2+2e-+4H++SO42- ===PbSO4+2H2O;充电时,H2SO4的浓度不断增大,阳极上发生的是氧化反应,是失去电子而不是得到电子。
答案:B。
16.(08江苏卷)工业上制备BaCl2的工艺流程图如下:
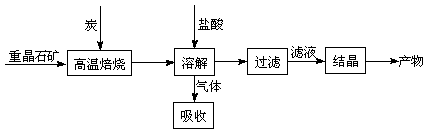
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得
BaSO4(s) + 4C(s) 4CO(g) + BaS(s)
△H1 = 571.2 kJ·mol-1 ①
4CO(g) + BaS(s)
△H1 = 571.2 kJ·mol-1 ①
BaSO4(s) + 2C(s) 2CO2(g) + BaS(s) △H2=
226.2 kJ·mol-1 ②
2CO2(g) + BaS(s) △H2=
226.2 kJ·mol-1 ②
⑴气体用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为 。
⑵向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,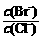 =
。
=
。
[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
⑶反应C(s) + CO2(g) 2CO(g)的△H2= kJ·mol-1。
2CO(g)的△H2= kJ·mol-1。
⑷实际生产中必须加入过量的炭,同时还要通入空气,其目的是
, 。
答案:⑴S2- + H2O HS- +OH-;HS- + H2O
HS- +OH-;HS- + H2O H2S +OH-(可不写。
H2S +OH-(可不写。
⑵2.7×10-3。⑶172.5。
⑷使BaSO4得到充分的还原(或提高BaS的产量)。
①②为吸热反应,炭和氧气反应放热维持反应所需高温。
2008高考化学分类解析9-电化学基础
15.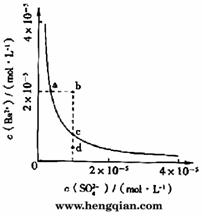 (08山东卷)某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
(08山东卷)某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
A.加入Na2SO4可以使溶液由a点变到b点
B.通过蒸发可以使溶液由d点变到c点
C.d点无BaSO4沉淀生成
D.a点对应的Kap大于c点对应的Kap
答案:C。解析:BaSO4(s) 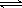 Ba2+(aq)+SO42-(aq)的平衡
Ba2+(aq)+SO42-(aq)的平衡
常数Ksp=c(Ba2+)·c(SO42-),称为溶度积常数。加入Na2SO4增大了SO42-浓度,平衡逆向进行,c(Ba2+)减少,故A错,蒸发时升高了温度,又溶解平衡是一个吸热反应,所以平衡正向进行,c(Ba2+)浓度增大,故B错;a点对应的Ksp小大于c点对应的Ksp,故D错,只有C对。
14.(08北京卷)下列叙述正确的是( )
A.将稀氨水逐滴加入稀硫酸中,当溶液的pH=7时,c(SO42-)>c(NH4+)
B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH的别为a和a+1,则c1=10c2
C.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D.向0.1mol·L-1的氨水中加入少量硫酸铵固体,则溶液中c(OH-)/c(NH3·H2O)增大
[解析]A中将稀氨水加入硫酸中,=7时,溶液中c(H+)=c(OH-), 根据电荷守恒原则,2c(SO42-)=c(NH4+),即c(SO42-)<c(NH4+),错误;B中由于醋酸是弱酸,故其PH相差10倍时,物质的量浓度不是相差10倍,错误;C中由于醋酸是弱酸,其在弱溶液中不完全电离,其电离部分恰好和氢氧化钠反应,未电离部分过量,故溶液呈酸性,滴入石蕊呈红色,正确;D中加硫酸铵时,电离产生的铵根离子使平衡左移,c(OH-)/c(NH3.H2O)减小,错误。
[答案]C
[高考考点]溶液中离子浓度比较、弱电解质电离平衡及其移动
[易错提醒]不能正确理解弱电解质电离的平衡的存在,造成BCD项错误判断
[备考提示]解答离子浓度大小比较试题,抓住一个原理、两类平衡、三种守恒进行分析,包括化学平衡移动原理,电离平衡和水解平衡,电荷守恒、物料守恒和质子守恒。其中电荷守恒是指溶液中阳离子所带正电荷总数等于阴离子所带负电荷总数,溶液电中性; 物料守恒是指某一组分的原始浓度应该等于它在溶液中各种存在形式的浓度之和;质子守恒是指溶液中由水电离出来的H+和OH-总是相等的。质子守恒可由电荷守恒和物料守恒联立推导出来。
13.(08北京卷)对水的电离平衡不产生影响的粒子是( )
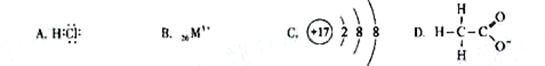
[解析]水的电离式为:H2O=H++OH-,A溶于水成为盐酸,电离产生的H+,使得平衡左移,B质子数为26的是Fe3+,其能发生水解,使得平衡右移,C表示的是Cl-,其不影响该平衡,D是醋酸根离子,其能水解,使平衡右移。
[答案]C
[高考考点]电离平衡的影响因素,化学用语知识
[易错提醒]不能正确理解26M3+中左下角标的含义,做出错误判断
[备考提示]此题涉及了电离平衡的知识,特别是能发生水解的离子对电离平衡的影响,重点是掌握解题的方法和技巧,明确化学用语的意义。
12.(08天津卷)醋酸溶液中存在电离平衡CH3COOH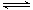 H++CH3COO-,下列叙述不正确的是( )
H++CH3COO-,下列叙述不正确的是( )
A.醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-)
B.0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)减小
C.CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动
D.常温下pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7
解析:根据电荷守恒,选项A中的等量关系成立;选项B中加水稀释,存在两种情况,一是加水电离平衡正向移动,使得c(OH-)增大,二是使得溶液的体积增大,溶液的c(OH-)减小,因此谁成为影响c(OH-)大小的因素不能确定;选项C中加入少量的固体CH3COONa,实际上相当于增大了CH3COO-,使平衡向逆向移动;选项D中pH=2的CH3COOH溶液中的c(H+)和pH=12的NaOH溶液中的c(OH-)相等,但由于CH3COOH为弱酸,CH3COOH只有部分电离,所以反应后溶液呈酸性。
答案:B。
11.(08全国Ⅱ卷)取浓度相同的NaOH和HCl溶液,以3∶2体积比相混合,所得溶液的pH等于12,则该原溶液的浓度为( )
A.0.01mol·L-1 B.0.017mol·L-1 C.0.05mol·L-1 D.0.50mol·L-1
解析:由题意可得: = 0.01,c=0.05mol·L-1。
答案:C。
10.(08全国Ⅱ卷)实验室现有3种酸碱指示剂,其pH的变色范围如下:
甲基橙:3.1-4.4 石蕊:50-8.0 酚酞:8.2-10.0
用0.1000mol·L-1NaOH溶液滴定未知浓度的CH3COOH溶液,反应恰好完全时,下列叙述正确的是( )
A.溶液呈中性,可选用甲基橙或酚酞作指示剂
B.溶液呈中性,只能选用石蕊作指示剂
C.溶液呈碱性,可选用甲基橙或酚酞作指示剂
D.溶液呈碱性,只能选用酚酞作指示剂
解析:NaOH与CH3COOH恰好完全反应生成CH3COONa,CH3COONa为强酸弱碱盐,水解后溶液呈碱性,为了减少滴定误差,应选择指示剂的pH范围与CH3COONa溶液pH接进,所以指示剂选择酚酞。
答案:D。
9.(08重庆卷)向三份0.1mol,L CH3COONa溶液中分别加入少量NH4NO3、Na2SO3、FeCl2因体(忽略溶液体积变化),则CH3COO-浓度的变化依次为( )
A.减小、增大、减小 B.增大、减小、减小
C.减小、增大、增大 D.增大、减小、增大
解析:CH3COONa为强碱弱酸盐水解后溶液呈碱性,NH4NO3和FeCl2为强酸弱碱盐水解后溶液呈酸性,因此,这两种盐能促进CH3COONa的水解,溶液中的CH3COO-增大;Na2SO3为强碱弱酸盐,水解后溶液呈碱性,抑制CH3COONa的水解,溶液中的CH3COO-浓度减小。
答案:D。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com