
题目列表(包括答案和解析)
24.(全国理综Ⅱ29).(17分)
A、B、C、D、E、F、G、H、I、J均为有机化合物,根据以下框图,回答问题:
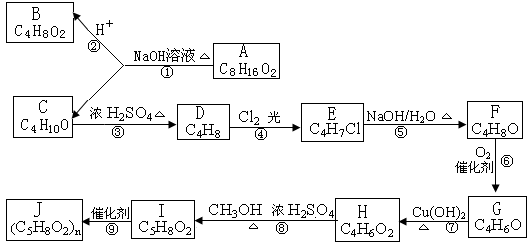
(1)B和C均为有支链`的有机化合物,B的结构式为 ;C在浓硫酸作用下加热反应只能生成一种烯烃D,D的结构简式为 。
(2)G能发生银镜反应,也能使溴的四氯化碳溶液褪色,则G的结构简式为
(3)写出⑤的化学反应方程式 。
⑨的化学反应方程式 。
(4)①的反应类型 ,④的反应类型 ,⑦的反应类型 。
(5)与H具有相同官能团的H的同分异构体的结构简式为 。

答案:(1),
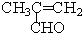
(2)
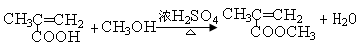 (3)
(3)

(4)水解,取代,氧化
(5)CH3CH=CHCOOH CH2=CHCH2COOH
2.边反应边蒸馏缩醛脱离反应体系,令化学平衡向正反应方向移动;
②写出用乙二醇保护苯甲醛中醛基的反应方程式:

1.CH3CH2OH过量,令化学平衡向正反应方向移动;
2.与羟基相连的碳链长,大大降低醛的产率与增大反应时间。
(3)请写出用空气代替氧气气氛进行反应的优缺点:
优点:原料易得,降低成本。防止苯甲醛氧化为苯甲酸。
缺点:令反应时间增长。
(4)写出苯甲醛被银氨溶液氧化的反应方程式
C6H5CHO+ 2Ag(NH3)2OH ==(水浴加热)== C6H5COONH4 + 2Ag ↓+ 3NH3↑ + H2O
(5)①在以上醛基保护反应中要保证反应的顺利进行,可采取的措施有(写出2条)
1.苯环上的取代基对醛的产率影响不大,对反应时间有一定影响。
23.(广东卷26).(10分)
醇氧化成醛的反应是药物、香料合成中的重要反应之一。
(1)苯甲醇可由C4H5CH2Cl在NaOH水溶液中发生取代反应而得,反应方程式为 。
(2)醇在催化作用下氧化成醛的反应是绿色化学的研究内容之一。某科研小组研究了把催化剂在氧气气氛中对一系列醇氧化成醛反应的催化效果,反应条件为:K2CO3、363K、甲苯(溶剂)。实验结果如下:

分析表中数据,得到把催化剂催化效果的主要结论是 (写出2条)。
(3)用空气代替氧气气氛进行苯甲醇氧化生成苯甲醛的反应,其他条件相同,产率达到95%时的反应时间为7.0小时。请写出用空气代替氧气气氛进行反应的优缺 点:
。
点:
。
(4)苯甲醛易被氧化。写出苯甲醛被银氨溶液氧化的反应方程式 (标出具体反应条件)。
(5)在药物、香料合成中常利用醛和醇反应生成综醛来保护醛基,此类反应在酸催化下进行。例如:

①在以上醛基保护反应中要保证反应的顺利进行,可采取的措施有 (写出2条)。
②已知具有五元环和六元环结构的缩醛比较稳定。写出用乙二醇(HOCH2CH3OH)保护苯甲醛中醛的反应方程式 。
解析:(1)苯甲醇可由C6H5CH2Cl在NaOH水溶液中发生取代反应而得,反应方程式为:

(2)分析表中数据,得到钯催化剂催化效果的主要结论是
22.(广东卷25).(9分)
某些高分子催化剂可用于有机合成。下面是一种高分子催化剂(Ⅶ)合成路线的一部分(Ⅲ和Ⅵ都是Ⅶ的单体;反应均在一定条件下进行;化合物Ⅰ-Ⅲ和Ⅶ中含N杂环的性质类似于苯环):

回答下列问题:
(1)写出由化合物Ⅰ合成化合物Ⅱ的反应方程式 (不要求标出反应条件)。
(2)下列关于化合物Ⅰ、Ⅱ和Ⅲ的说法中,正确的是 (填字母)。
A.化合物Ⅰ可以发生氧化反应
B.化合物Ⅰ与金属钠反应不生成氢气
C.化合物Ⅱ可以发生水解反应
D.化合物Ⅲ不可以使溴的四氯化碳深液褪色
E.化合物Ⅲ属于烯烃类化合物
(3)化合物Ⅵ是 (填字母)类化合物。
A.醇 B.烷烃 C.烯烃 D.酸 E.酯
(4)写出2种可鉴别V和M的化学试剂
(5)在上述合成路线中,化合物Ⅳ和V在催化剂的作用下与氧气反应生成Ⅵ和水,写出反应方程式 (不要求标出反应条件)
解析:(1)写出由化合物I合成化合物II的反应方程式:

(2)ACE 解释:化合物I官能团有羟基,碳碳双键,故可发生氧化反应,也可以与金属钠发生反应生成氢气,故A正确,B错误。化合物II官能团有酯基,可以发生水解发生,生成相应的酸和醇,故C正确。化合物III的官能团有碳碳双键,可以使溴的四氯化碳溶液褪色,属于以乙烯为母体的烯烃类衍生物,故D错误,E正确。
(3)化合物VI是E(酯类)化合物。 解释:化合物VI的结构为:

(4)写出两种可鉴别V和VI的化学试剂:1.溴的四四氯化碳溶液;2.Na2CO3溶液
解释:化合物V为乙酸,含有羧基,可与Na2CO3溶液反应,生成CO2,化合物VI则不能。化合物VI中,含有碳碳双键,可使溴的四四氯化碳溶液褪色,化合物V则不能。
(5)在上述合成路线中,化合物IV和V在催化剂作用下与氧气反应生成VI和水,写出反应方程式
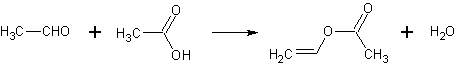
21.(重庆卷28).(16分)天然气化工是重庆市的支柱产业之一.以天然气为原料经下列反应路线可得工程塑料PBT.


(1)B分子结构中只有一种氢、一种氧、一种碳,则B的结构简式是 ;B的同分异构体中与葡萄糖具有类似结构的是 .(写结构简式)
(2)F的结构简式是 ;PBT属于 类有机高分子化合物.
(3)由A、D生成E的反应方程式为 ,其反应类型为 .
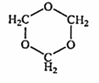 (4)E的同分异构体G不能发生银镜反应,能使溴水褪色,能水解且产物的碳原子数不等,则G在NaOH溶液中发生水解反应的化学方程式是
.
(4)E的同分异构体G不能发生银镜反应,能使溴水褪色,能水解且产物的碳原子数不等,则G在NaOH溶液中发生水解反应的化学方程式是
.
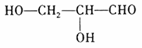 [标准答案](1)
[标准答案](1)
(2)HO-CH2-CH2-CH2-CH2-OH;酯(或聚酯)
 (3)HC≡CH+2HCHO
(3)HC≡CH+2HCHO HOCH3C≡CCH2OH;加成反应
HOCH3C≡CCH2OH;加成反应
(4)CH2=CH-COOCH3+NaOH CH2=CH-COONa+CH3OH
CH2=CH-COONa+CH3OH
[试题分析](1)甲醇在铜作催化剂的条件下可被氧化成甲醛,结合B的化学式,可推断应为三分子甲醛的反应;葡萄糖具有羟基和醛基两种官能团。根据B的化学式不难写出其含有这两种官能团的同分异构。(2)(3)由机理分析,碳碳叁键与羰基在碱性条件下可以反应,A+D→E,明显就是要运用这个机理,结合F,根据碳原子守恒,D中必须含有有三个碳,即丙炔,此反应属于加成反应;E→F应为碳碳叁键的加成反应; F →PBT是通过与二元羧酸的聚合反应,则PBT应为酯。(4)G能在碱性条件下发生水解,说明为酯类物质,又能使溴水褪色,说明含有碳碳双键。不能银镜,说明不是甲酸形成的酯,则只能是丙烯酸和甲醇形成的酯。
[高考考点]有机框图推断
[易错提醒]不会合理运用信息
[备考提示]研读题给信息,适时迁移课本中的知识。
20.(山东卷33).
苯丙酸诺龙是一种兴奋剂,结构简式为:

⑴由苯丙酸诺龙的结构推测,它能 (填代号)。
a.使溴的四氯化碳溶液褪色 b.使酸性KMnO4溶液褪色
c.与银氨溶液发生银镜反应 d.与Na2CO3溶液作用生成CO2
苯丙酸诺龙的一种同分异构体A,在一定条件下可发生下列反应:
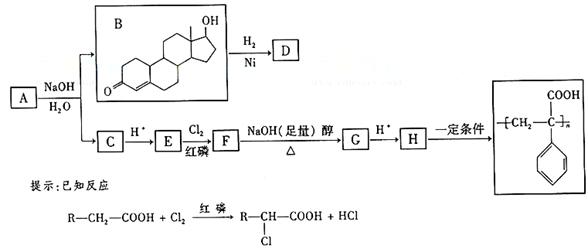
据以上信息回答⑵-⑷题:
⑵B→D的反应类型是 。
⑶C的结构简式为 。
⑷F→G的化学方程式是 。
答案:⑴a、b;⑵加成反应(或还原反应)
19.(山东卷29).(12分)北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。
⑴丙烷脱氢可得丙烯。
已知:C3H8(g)====CH4(g)+HC≡CH(g)+H2(g) △H1=156.6kJ·mol-1
CH3CH=CH2(g)====CH4(g)+HC≡CH(g) △H2=32.4kJ·mol-1
则相同条件下,反应C3H8(g)====CH3CH=CH2 (g)+H2(g)的△H= kJ·mol-1。
⑵以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为 ;放电时,CO32-移向电池的 (填“正”或“负”)极。
⑶碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3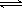 HCO3-+H+的平衡常数K1=
。(已知:10-5.60=2.5×10-6)
HCO3-+H+的平衡常数K1=
。(已知:10-5.60=2.5×10-6)
⑷常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中c(H2CO3) c(CO32-)(填“>”、“=”或“<”),原因是 (用离子方程式和必要的文字说明)。
答案:⑴124.2;⑵C3H8+5O2=3CO2+4H2O;负;⑶4.2×10-7 mol·L-1;⑷> HCO3-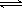 CO32-+H+
CO32-+H+
HCO3-+H2O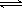 H2CO3+OH-、HCO3-的水解程度大于电离程度
H2CO3+OH-、HCO3-的水解程度大于电离程度
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com