
题目列表(包括答案和解析)
6.(08江苏卷)化学与生活、社会密切相关。下列说法不正确的是( )
A.利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境
B.凡含有食品添加剂的食物对人体健康均有害,不可食用
C.为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术
D.提倡人们购物时不用塑料袋,是为了防止白色污染
 解析:食品添加剂是用于改善食品品质,延长食品保存期,添加食品营养成分的一类化学合成或天然物质,所以含有食品添加剂的食物对人体的健康不一定有坏。
解析:食品添加剂是用于改善食品品质,延长食品保存期,添加食品营养成分的一类化学合成或天然物质,所以含有食品添加剂的食物对人体的健康不一定有坏。
答案:B。
5.(08广东卷)海水是一个巨大的化学资源库,下列有关海水综合利用的说法正确的是( )
A.海水中含有钾元素,只需经过物理变化就可以得到钾单质
B.海水蒸发制海盐的过程中只发生了化学变化
C.从海水中可以得到NaCl,电解熔融NaCl可制备Cl2
D.利用潮汐发电是将化学能转化为电能
解析:海水中钾元素以K+形式存在,生成钾单质必然发生化学反应,A错。蒸发制海盐发生的是物理变化,B错。潮汐发电是将动能转化为电能,D错。
答案:C
4.(08上海卷)植物及其废弃物可以制取乙醇燃料,下列关于乙醇燃料的说法错误的是( )
A.它是一种再生能源 B.乙醇易燃烧,污染小
C.乙醇只能在实验室内作燃料 D.粮食作物是制乙醇的重要原料
解析:乙醇不仅在实验室内可作燃料,而且还可作还可作内燃机等的燃料。
答案:C
3.(08上海卷)食品检验是保证食品安全的重要措施,下列不属于食品安全检测指标的是( )
A.淀粉的含量 B.二氧化硫的含量
C.亚硝酸盐的含量 D.甲醛的含量
解析:选项B、C、D都是有毒物质,是食品安全检测的指标。
答案:A
2.与氨碱法比较,下列关于联合制碱法优点的判断中不正确的是( )
A.提高了原料的原子利用率 B.降低了生产成本
C.减少了环境污染 D.减轻了对设备的腐蚀
答案:B
1.(08海南卷)普钙是目前使用最广泛的磷肥,其主要成分是( )
A.Ca5(PO4)3F B. Ca(H2PO4)2·H2O和CaSO4
C.Ca3(PO4)2和CaHPO4 D.CaHPO4和Ca(H2PO4)2
答案:B
14.(08上海卷)小苏打、胃舒、平达喜都是常用的中和胃酸的药物。
(1)小苏打片每片含0.5gNaHCO3,2片小苏打片和胃酸完全中和,被中和的H+是___________mol。
(2)胃舒平每片含0.245gAl(OH)3。中和胃酸时,6片小苏打片相当于胃舒平_____片。
(3)达喜的化学成分是铝和镁的碱式盐。
①取该碱式盐3.01g,加入2.0mol·L-1盐酸使其溶解,当加入盐酸42.5mL时,开始产生CO2,加入盐酸至45.0mL时正好反应完全,计算该碱式盐样品中氢氧根与碳酸根的物质的量之比。
②在上述碱式盐溶于盐酸后的溶液中加入过量的氢氧化钠,过滤,沉淀物进行干燥后重1.74g,若该碱式盐中氢元素的质量分数为0.040,试推测该碱式盐的化学式。
解析:(1)2片小苏打所含NaHCO3的质量为1g,其物质的量为=0.012mol,
由HCO3-+H+===CO2↑+H2O,可知n(H+)=0.012mol。
(2)6片小苏打的物质的量为:=0036mol,即中和的H+为0.036mol,而每片的Al(OH)3的物质的量为=0.0031mol,由Al(OH)3+3H+ ===Al3++3H2O,所以Al(OH)3的片数为:=3.8片。
(3)①碱式盐中加入HCl,首先是碱式盐中的OH-和CO32-与H+反应生成H2O和HCO3-,所以n(HCO3-)=2.0mol·L-1×0.0025L=0.005mol,即n(CO32-)=0.005mol,H+与CO32-与HCl反应的H+的总物质的量为:2.0mol·L-1×0.0425L=0.085mol,所以n(OH-)=0.08mol,它们的物质的量之比为:16∶1。
②能与过量的NaOH溶液反应产生沉淀的只有Mg2+,所以n[Mg(OH)2]==0.03mol,若碱式盐中不含结晶水,则氢元素的质量分数为:0.08mol×1g/mol=0.08g,氢元素的质量分数为:=0.027<0.04,说明碱式盐中含有结晶水,根据题意有:m(Al)+m(H2O)+0.03mol×24g/mol+0.005mol×60g/mol+0.08mol×17g/mol=3.01g,=0.04,所以m(H2O)=0.36g,n(H2O)=002mol,m(Al)=0.27g,n(Al)=001mol,所以n(Al3+)∶n(Mg2+)∶n(OH-)∶n(CO32-)∶n(H2O)=0.01mol∶0.03mol∶0.08mol∶0.005mol∶0.02mol=2∶6∶16∶1∶4,即碱式盐的化学式为:Al2Mg6(OH)16CO3·4H2O。
答案:(1)0.012mol。
(2)3.8。
(3)n(OH-)∶n(CO32-)=16∶1。
(4)Al2Mg6(OH)16CO3·4H2O。
2008年高考化学分类解析13-化学与生活、环境和工业
13.(08上海卷)生态溶液涉及农家肥料的综合利用,某种肥料经发酵得到一种含有甲烷、二氧化碳、氮气的混合气体。2.016L(标准状况)该气体通过盛有红色CuO粉末的硬质玻璃管,发生的反应为:CH4+4CuO CO2+2H2O+
CO2+2H2O+
4Cu。当甲烷完全反应后,硬质玻璃管的质量减轻4.8g。将反应后产生的气体通过过量的澄清石灰水,充分吸收,生成沉淀8.5g。
(1)原混合气体中甲烷的物质的量是____________。
(2)原混合气体中氮气的体积分数为多少?(写出计算过程)
解析:由于硬质玻璃管减少的质量为CuO中的氧的质量,所以n(CuO)==0.3mol,由方程式可知反应的CH4的物质的量为0.075mol。生成的CO2也为0.075mol,将气体通过澄清的石灰水生成8.5g沉淀,所以n(CO2)=0.085mol,原混合气体中的n(CO2)=0.01mol,而气体的总物质的量为:=0.09mol,所以n(N2)=0.005mol,N2的体积分数为:×100%=5.56%。
答案:(1)0.075mol。
(2)5.56%。
12.(08四川卷)在Al2(SO4)3和(NH4)2SO4的混合溶液中加入bmol的BaCl2,恰好使溶液中的SO42-完全沉淀;如加入足量强碱并加热可得到cmolNH3,则原溶液中的Al3+的浓度(mol/L)为( )
A. B. C. D.
解析:由于NH3的物质的量为cmol,由原子守恒和电荷守恒得:(NH4)2SO4的物质的量为mol,反应时用去的BaCl2的物质的量也为mol,剩余的BaCl2为(b-)mol,则Al2(SO4)3中的SO42-的物质的量也为(b-)mol,由电荷守恒得:n(Al3+)×3=(b-)×2,所以c(Al3+)=mol/L。
答案:C。
11.(08山东卷)NA代表阿伏加德罗常数,下列叙述错误的是( )
A.10 mL质量分数为98%的H2SO4,用水稀释至100 mL,H2SO4的质量分数为9.8%
B.在H2O2+Cl2=2HCl+O2反应中,每生成32 g氧气,则转移2NA个电子
C.标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量为28 g
D.一定温度下,1 L 0.50 mol·L-1 NH4Cl溶液与2 L 0.25 mol·L-1 NH4Cl溶液含NH+4物质的量不同
解析:选项A中根据稀释前后溶质的质量不变得:10mL×ρ(前)×98%=100mL×ρ(后)×ω(后),所以ω(后)=,由于反应前后溶液的密度不能确定,所以其质量分数也不能确定;选项B中n(O2)=1mol,O元素的化合价从-1价变为0价,所以每个O原子失去1个电子,故反应中转移的电子数为2NA;选项C中分子数为NA的CO和C2H4其物质的量为1mol,则在标准状况下所占的体积为22.4L,由于它们的摩尔质量都是28g·mol-1,即平均摩尔质量也为28g·mol-1,所以其质量为28g;选项D中由于NH4++H2O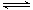 NH3·H2O+OH-,浓度越小,水解程度越大,所以溶液中所含NH4+的物质的量不同。
NH3·H2O+OH-,浓度越小,水解程度越大,所以溶液中所含NH4+的物质的量不同。
答案:A。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com