
题目列表(包括答案和解析)
5.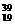 K分别与
K分别与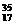 Cl和
Cl和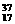 Cl(氯的相对原子质量为35.5)构成的12.7 g氯化钾中,含
Cl(氯的相对原子质量为35.5)构成的12.7 g氯化钾中,含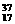 Cl的质量是
Cl的质量是
A.1.49克 B.1.50克
C.1.55克 D.1.58克
4.下列叙述中,正确的是
A.两种粒子,若核外电子排布完全相同,则其化学性质一定相同
B.凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布
C.两原子,如果核外电子排布相同,则一定属于同种元素
D.阴离子的核外电子排布一定与上一周期稀有气体元素原子的核外电子排布相同
3.原子序数为47的银元素有两种同位素,它们所占的原子百分比近似相等。已知银元素的近似平均相对原子质量为108,则两种同位素原子中的中子数分别为
A.110和106 B.57和63
C.60和62 D.53和73
2.某粒子含有6个电子、7个中子,净电荷数为0,则它的化学符号可能是
A.13Al B.13Al
C.13C D.13C
1.(2001年上海高考题)美国科学家将铅和氪的原子对撞,获得了一种质子数为118,中子数为175的超重元素。该元素原子核内的中子数与核外电子数之差为
A.57 B.47
C.61 D.293
17.(8分)不同元素的原子在分子内吸引电子的能力大小可用一定数值x来表示,若x值越大,其原子吸引电子能力越强,在所形成的分子中成为负电荷一方;若两种非金属元素原子的x值相差越大,在形成的化合物中共价键的极性就越强。下面是原子序数为3-19号元素的x值(稀有气体元素除外):
|
元素 |
Li |
Be |
B |
C |
N |
O |
F |
Na |
|
x值 |
0.98 |
1.57 |
2.04 |
2.55 |
3.04 |
3.44 |
3.98 |
0.93 |
|
元素 |
Mg |
Al |
Si |
P |
S |
Cl |
K |
|
|
x值 |
1.31 |
1.61 |
1.90 |
2.19 |
2.58 |
3.16 |
0.82 |
|
(1)推测x值与原子半径关系是 。这些主族元素x值的这种变化特点体现了元素性质的 变化规律。
(2)通过分析x值变化规律,估计Ca的x值范围: <x(Ca)< ;预测在卤素的四种气态氢化物中, 是共价键极性最弱的分子(请填写化学式)。
(3)次卤酸(HXO)的电子式为 (卤素原子用X表示);根据上表x值,可判断在次氟酸(HFO)中,元素F、O的价态分别为 、 。
16.(8分)A、B、C、D均为短周期元素,B与A可形成两种液态化合物,其原子个数比分别为1∶1和2∶1,且分子中电子总数分别为18和10;B与D能形成一种极易溶于水的碱性气体X,B与C能形成极易溶于水的酸性气体Y。X分子与B2A分子中的电子数相同。Y分子中的电子数为18,A、B、D可形成离子化合物,其化学式为B4A3D2,其水溶液呈弱碱性。请回答:
(1)元素符号:A ,B ,C ,D 。
(2)写出化学方程式:C2和X(过量)反应 。
(3)B4A3D2的化学式 ,其水溶液呈酸性的离子方程式 。
(4)液态X能电离(可根据B2A电离推知),其阴离子电子式 。
15.(6分)有X、Y、Z、W四种短周期元素,原子序数依次增大,其核电荷数总和为38。Y元素原子最外层电子数占核外电子总数的3/4,W元素原子最外层电子比同周期Z元素多5个电子,且W和Y不属于同一主族。
(1)写出元素符号:X ,Y ,Z ,W 。
(2)Z、W两元素最高价氧化物对应水化物之间发生反应的方程式是 。
14.(9分)不同元素的原子在分子内吸引电子的能力大小可用一定数值x来表示,若x越大,其原子吸引电子能力越强,在所形成的分子中成分为带负电荷的一方。
下面是某些短周期元素的x值:
|
元素符号 |
Li |
Be |
B |
C |
O |
F |
Na |
Al |
Si |
P |
S |
Cl |
|
x值 |
0.98 |
1.57 |
2.04 |
2.25 |
3.44 |
3.98 |
0.93 |
1.61 |
1.90 |
2.19 |
2.58 |
3.16 |
(1) 通过分析x值变化规律,确定Mg、N的x值范围:
<x(Mg)< , <x(N)< 。
(2)推测x值与原子半径的关系是 。据据短周期元素的x值变化特点,体现了元素性质的 变化规律。
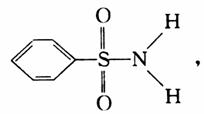
(3)某有机化合物结构式为: 其中S-N键中你认
为共用电子对偏向谁? (写原子名称)。
(4)经验规律告诉我们:当成键的两原子相应元素的x差值(Δx)即Δx>1.7时,一般为离子键,Δx<1.7,一般为共价键,试推断:AlBr3中化学键类型是 。
(5)预测元素周期表中,x值最小的元素的位置: (放射性元素除外)。
13. (8分)A、B、C、D都是短周期元素,原子半径D>C>A>B。其中A、B处于同一周期,A、C处于同一主族。C原子核内的质子数等于A、B原子核内质子数之和,C原子最外层电子数是D原子最外层电子数的4倍。试回答:
(1)这四种元素分别是:A ,B ,C ,D 。
(2)这四种元素单质的熔点由高到低的顺序是 。
(3)写出A、B、D组成的化合物与B、C组成的化合物相互反应的化学方程式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com