
题目列表(包括答案和解析)
21、(2008年天津)下列叙述正确的是
A、在原电池的负极和电解池的阴极上都是发生失电子的氧化反应
B、用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2
C、用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 molNaOH
D、镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀
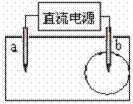 22.
(2008年上海)取一张用饱和NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通
22.
(2008年上海)取一张用饱和NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通
直流电源,一段时间后,发现电极与试纸接触处出现一个双色同心圆,内圆
为白色,外圆呈浅红色。则下列说法错误的是
A.b电极是阴极 B.a电极与电源的正极相连接
C.电解过程中,水是氧化剂 D.b电极附近溶液的pH变小
20、(2008年重庆)如题12图所示,将紧紧缠绕不同金属的铁钉放入培养皿中,再加入含有适量酚酞和NaCl的琼脂热溶液,冷却后形成琼胶(离子在琼胶内可以移动)。下列叙述正确的是
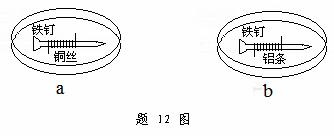 A、a中铁钉附近呈现红色
A、a中铁钉附近呈现红色
B、b中铁钉上发生还原反应
C、a中铜丝上发生氧化反应
D、b中铝条附近有气泡产生
19.(2007年江苏某同学按右图所示的装置进行电解实验。下列说法正确的是
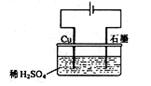 A.电解过程中,铜电极上有H2产生
A.电解过程中,铜电极上有H2产生
B.电解初期,主反应方程式为:Cu+H2SO4 CuSO4+H2↑
CuSO4+H2↑
C.电解一定时间后,石墨电极上有铜析出
D.整个电解过程中,H+的浓度不断增大
18、(2007福建卷)以惰性电极电解CuSO4溶液,若阳极析出气体0.01mol,则阴极上析出Cu为
A、0.64g B、1.28g C、2.56g D、5.12g
17.(2007年全国II)在盛有稀H2SO4的烧杯中放入导线连接的锌片和铜片,下列叙述正确的是
A.正极附近的SO42-离子浓度逐渐增大
B.电子通过导线由铜片流向锌片
C.正极有O2逸出
D.铜片上有H2逸出
16.(2007天津卷)天津是我国研发和生产锂离子电池的重要基地。锂离子电池正极材料是含锂的二氧化钴(LiCoO2),充电时LiCoO2中Li被氧化,Li+迁移并以原子形式嵌入电池负极材料碳(C6)中,以LiC6表示。电池反应为LiCoO2 + C6  CoO2 + LiC6 ,下列说法正确的是
CoO2 + LiC6 ,下列说法正确的是
A.充电时,电池的负极反应为 LiC6 - e- == Li + C6
B.放电时,电池的正极反应为 CoO2 + Li+ + e- == LiCoO2 ,
C.羧酸、醇等含活泼氢的有机物可用作锂离子电池的电解质
D.锂离子电池的比能量(单位质量释放的能量)低
15.(2007天津卷)下列有关工业生产的叙述正确的是
A.合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率
B.硫酸工业中,在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量
C.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的C12进入阳极室
D.电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小
14.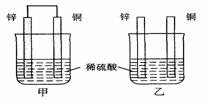 (2006年上海卷)将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是
(2006年上海卷)将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是
A 两烧杯中铜片表面均无气泡产生
B 甲中铜片是正极,乙中铜片是负极
C 两烧杯中溶液的pH均增大
D 产生气泡的速度甲比乙慢
13. (2006年全国)把分别盛有熔融的氯化钾、氯化镁、氯化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钾、镁、铝的物质的量之比为
A.1:2:3 B.3:2:1 C.6:3:1 D.6:3:2
12.(2006年江苏卷)锂离子电池已经成为新一代实用化的蓄电池,该电池具有能量密度大、电压高的特性。锂离子电池放电时的电极反应式为
负极反应:C6Li-xe-===C6Li1-x+xLi+(C6Li表示锂原子嵌入石墨形成的复合材料)
正极反应:Li1-xMO2+xLi++x e-===LiMO2(LiMO2表示含锂的过渡金属氧化物)
下列有关说法正确的是
A.锂离子电池充电时电池反应为C6Li+Li1-xMO2===LiMO2+C6Li1-x
B.电池反应中,锂、锌、银、铅各失去1mol电子,金属锂所消耗的质量最小
C.锂离子电池放电时电池内部Li+向负极移动
D.锂离子电池充电时阴极反应为C6Li1-x+xLi++x e-===C6Li
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com