
题目列表(包括答案和解析)
41、(2006年北京卷)(14分)铝和氢氧化钾都是重要的工业产品。请回答:
(1)工业冶炼铝的化学方程式是 。
(2)铝与氢氧化钾反应的离子方程式是 。
(3)工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。电解槽内装
有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。

①该电解槽的阳极反应式是 。
②通电开始后,阴极附近溶液pH会增大,请简述原因
⑶① 4OH?? 4e? = 2H2O + O2↑② H+放电,促进水的电离,OH?浓度增大③ B
③除去杂质后氢氧化钾溶液从液体出口 (填写“A”或“B”)导出。
40、(2005年全国)(15分)X、Y、Z、W为按原子序数由小到大排列的四种短周期元素。
已知:①X可分别与Y、W形成X2Y,X2Y2、XW等共价化合物;
②Z可分别与Y、W形成Z2Y、Z2Y2、ZW等离子化合物。
请回答:
(1)Z2Y的化学式是 。
(2)Z2Y2与X2Y反应的化学方程式是 。
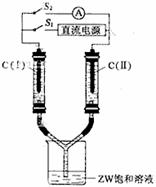 (3)如图所示装置,两玻璃管中盛满滴有酚酞溶液的ZW饱和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极。
(3)如图所示装置,两玻璃管中盛满滴有酚酞溶液的ZW饱和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极。
接通S1后,C(Ⅰ)附近溶液变红,两玻璃管中有气体生成。一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转。此时:
C(I)的电极名称是 (填写正极或负极);
C(II)的电极反应式是 。
(4)铜屑放入稀硫酸不发生反应,若在稀硫酸中加入X2Y2,铜屑可逐渐溶解,该反应的离子方程式是 。
39.(2004全国)在玻璃圆筒中盛有两种无色的互不相溶的中性液体。上层液体中插入两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅棒,可以上下搅动液体,装置如右图。接通电源,阳极周围的液体呈现棕色,且颜色由浅变深,阴极上有气泡生成。停止通电,取出电极,用搅棒上下剧烈搅动。静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色。根据上述实验回答:
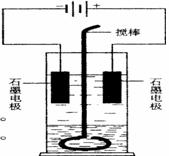 (1)阳极上的电极反应式为_____________________。
(1)阳极上的电极反应式为_____________________。
(2)阴极上的电极反应式为_____________________。
(3)原上层液体是_____________________________。
(4)原下层液体是______________________________。
(5)搅拌后两层液体颜色发生变化的原因是________
(6)要检验上层液体中含有的金属离子,其方法是______________,
现象是_______________________________
_____________。
38.(08海南卷)如何防止铁的锈蚀是工业上研究的重点内容。为研究铁锈蚀的影响因素,某同学做了如下探究实验:
|
序号 |
内容 |
实验现象 |
|
1 |
常温下将铁丝放在干燥空气中一个月 |
干燥的铁丝表面依然光亮 |
|
2 |
常温下将铁丝放在潮湿空气中一小时 |
铁丝表面依然光亮 |
|
3 |
常温下将铁丝放在潮湿的空气中一个月 |
铁丝表面已变得灰暗 |
|
4 |
将潮湿的铁丝放在常温的氧气流中一小时 |
铁丝表面略显灰暗 |
|
5 |
将潮湿的铁丝放在高于常温的氧气流中一小时 |
铁丝表面已变得灰暗 |
|
6 |
将浸过氯化钠溶液的铁丝放在高于常温的氧气流中一小时 |
铁丝表面灰暗程度比实验5严重 |
回答以下问题:
(1)上述实验中发生了电化学腐蚀的是(填实验序号) __________; 在电化学腐 蚀中,负极反应是________________; 正极反应是_______________________;
(2)由该实验可知,可以影响铁锈蚀速率的因素是___________________________; (3)为防止铁的锈蚀,工业上普遍采用的方法是______________(答两种方法)
37.(08北京卷)据报道,我国拥有完全自主产权的氢氧燃料电池车将在奥运会期间为运动员提供服务。某种氢氧燃料电池的电解液为KOH溶液。下列有关电池的叙述不正确的是( )
A.正极反应式为:O2+2H2O+4e- ===4OH-
B.工作一段时间后,电解液中的KOH的物质的量不变
C.该燃料电池的总反应方程式为:2H2+O2===2H2O
D.用该电池电解CuCl2溶液,产生2.24LCl2(标准状况)时,有0.1mol电子转移
36.(08天津卷)下列叙述正确的是( )
A.在原电池的负极和电解池的阴极上都是发生失电子的氧化反应
B.用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2
C.用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 molNaOH
D.镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀
35.(08广东卷)电池是人类生产和生活中的重要能量来源,各式各样电池的发展是化学对人类的一项重大贡献。下列有关电池的叙述正确的是( )
A.锌锰干电池工作一段时间后碳棒变细
B.氢氧燃料电池可将热能直接转变为电能
C.氢氧燃料电池工作时氢气在负极被氧化
D.太阳能电池的主要材料是高纯度的二氧化硅
34.(08广东卷)下列有关金属腐蚀与防护的说法正确的是( )
A.纯银器表面在空气中因化学腐蚀渐渐变暗
B.当镀锡铁制品的镀层破损时,镶层仍能对铁制品起保护作用
C.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀
33. (2008年广东卷)LiFePO4电池具有稳定性高、安全、对环境友好等优点,可用于电动汽车。电池反应为:FePO4+Li LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含U导电固体为电解质。下列有关LiFePO4电池说法正确的是
LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含U导电固体为电解质。下列有关LiFePO4电池说法正确的是
A.可加入硫酸以提高电解质的导电性
B放电时电池内部Li向负极移动.
C.充电过程中,电池正极材料的质量减少
D.放电时电池正极反应为:FePO4+Li++e-=LiFePO4
32.(2008年北京卷)据报道,我国拥有完全自主产权的氢氧燃料电池车将在北京奥运会期间为运动员提供服务。某种氢氧燃料电池的电解液为KOH溶液。下列有关该电池的叙述不正确的是
A.正极反应式为:O2+2H2O+4e-=4OH―
B.工作一段时间后,电解液中KOH的物质的量不变
C.该燃料电池的总反应方程式为:2H2+O2=2H2O
D.用该电池电解CuCl2溶液,产生2.24LCl2(标准状况)时,有0.1mol电子转移
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com