
题目列表(包括答案和解析)
4. (2008年上海)在2L密闭容器内,800℃时反应:2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
|
时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
|
n(NO)(mol) |
0.020 |
0.01. |
0.008 |
0.007 |
0.007 |
0.007 |
⑴写出该反应的平衡常数表达式:K= 。
 已知:
已知: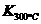 >
>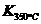 ,则改反应是 热反应。
,则改反应是 热反应。
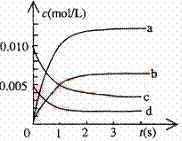
⑵右图中表示NO2的变化的曲线是 。
用O2表示从0~2s内该反应的平均速率v= 。
⑶能说明该反应已达到平衡状态的是 。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆 (NO)=2v正 (O2) d.容器内密度保持不变
⑷ 为使该反应的反应速率增大,且平衡向正反应方向移动的是 。
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
3.(11分)(2007山东卷) 二氧化硫和氮的氧化物是常用的工业原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。
(1)硫酸生产中,SO2催化氧化成SO3:

2SO2(g)+O2(g) 2SO3(g)
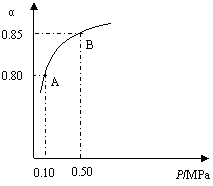
某温度下,SO2的平衡转化率(α)与体系总压强
(P)的关系如右图所示。根据图示回答下列问题:
①将2.0mol SO2和1.0mol O2置于10L密闭容器中,反应达平衡后,
体系总压强为0.10 MPa。该反应的平衡常数等于 。
②平衡状态由A变到B时,平衡常数
K(A) K(B)(填“>”、“<”或“=”)。
(2)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
若用标准状况下4.48LCH4还原NO2至N2,整个过程中转移的电子总数为 (阿伏伽德罗常数用NA表示),放出的热量为 kJ。
(3)新型纳米材料氧缺位铁酸盐(MFe2Ox 3<x<4,M=Mn、Co、Zn或Ni)由铁酸盐(MFe2O4)经高温还原而得,常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如图所示:
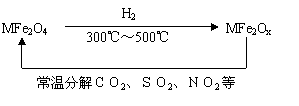
请写出MFe2Ox分解SO2的化学方程式 (不必配平)。
2. (2006年上海卷)(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示______________,K值大小与温度的关系是:温度升高,K值______________。(填一定增大、一定减小、或可能增大也可能减小)。
(2006年上海卷)(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示______________,K值大小与温度的关系是:温度升高,K值______________。(填一定增大、一定减小、或可能增大也可能减小)。
(2)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:
CO(g)+H2O(g)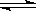 CO2(g)+H2(g)+Q(Q>0)
CO2(g)+H2(g)+Q(Q>0)
 CO和H2O浓度变化如右图,则0-4min的平均反应速率v(CO)=______mol/(L·min)
CO和H2O浓度变化如右图,则0-4min的平均反应速率v(CO)=______mol/(L·min)
(3)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如右表。
①表中3min-4min之间反应处于_________状态;
C1数值________0.08mol/L(填大于、小于或等于)。
②反应在4min-5min问,平衡向逆方向移动,可能的原因是________(单选),
表中5min-6min之间数值发生变化,可能的原因是________(单选)。
A 增加水蒸气 B 降低温度
C 使用催化剂 D 增加氢气浓度
1.(2004年全国)恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反 应:N2 (g) +
3 H2(g)
2NH3(g)
(1)若反应进行到某时刻t时,nt (N2) = 13mol,nt (NH3) = 6mol,计算a的值
(2)反应达平衡时,混合气体的体积为726.8L(标况下),其中NH3的含量(体积分数)为25%。
应:N2 (g) +
3 H2(g)
2NH3(g)
(1)若反应进行到某时刻t时,nt (N2) = 13mol,nt (NH3) = 6mol,计算a的值
(2)反应达平衡时,混合气体的体积为726.8L(标况下),其中NH3的含量(体积分数)为25%。
计算平移时NH3的物质的量。
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),n(始)∶n(平) = 。
(4)原混合气体中,a∶b = 。
(5)达到平衡时,N2和H2的转化率之比, (N2)∶
(N2)∶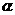 (H2)= 。
(H2)= 。
(6)平衡混合气体中,n(N2)∶n(H2)∶n(NH3) = 。
46.(08山东卷)高温下,某反应达平衡,平衡常数K=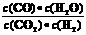 .恒容时,温度升高,H2浓度减小。下列说法正确的是( )
.恒容时,温度升高,H2浓度减小。下列说法正确的是( )
A.该反应的焓变为正值
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小
D.该反应化学方程式为CO+H2O=CO2+H2
45.(08宁夏卷)将固体NH4I置于密闭容器中,在一定温度下发生下列反应:
①NH4I(s)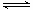 NH3(g)+HI(g);②2HI(g)
NH3(g)+HI(g);②2HI(g)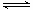 H2(g)+I2(g)。
H2(g)+I2(g)。
达到平衡时,c(H2)=0.5mol·L-1,c(HI)=4mol·L-1,则此温度下反应①的平衡常数为( )
A.9 B.16 C.20 D.25
44.(08广东卷)碘钨灯比白炽灯使用寿命长。灯管内封存的少量碘与使用过程中沉积在管壁上的钨可以发生反应:W(s)+I2(g)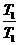 WI2ΔH<0(温度T1<T2)。下列说法正确的是( )
WI2ΔH<0(温度T1<T2)。下列说法正确的是( )
A.灯管工作时,扩散到灯丝附近高温区的WI2(g)会分解出W1W重新沉积到灯丝上
B.灯丝附近温度越高,WI2(g)的转化率越低
C.该反应的平衡常数表达式是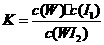
D.利用该反应原理可以提纯钨
43.(08广东卷)将H2(g)和Br2(g)充入恒容密闭容器,恒温下发生反应H2(g)+Br2(g) 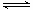 2HBr(g)
2HBr(g)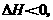 g平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是( )
g平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是( )
A.a>b B.a=b C.a<b D.无法确定
42.(08全国Ⅰ卷)已知:4NH3(g)+5O2(g)=4NO(g)+6H2(g). △H=-1025kJ/mol该反应是一个可逆反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是( )
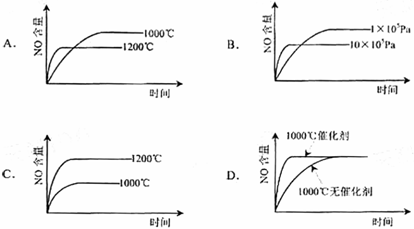
41.(08上海卷)等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生气体体积V的数据,根据数据绘制得到图1,则曲线a、b、c、d所对应的实验组别可能是( )
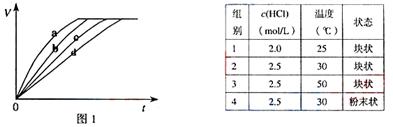
A.4-3-2-1 B.1-2-3-4 C.3-4-2-1 D.1-2-4-3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com