
题目列表(包括答案和解析)
3.(广东省深圳一模)下列离子方程式中,表达正确的是
A.向 NaHS 溶液中通入适量氯气:HS―+Cl2 =S↓+H++2Cl―
B.向 Fe(OH)3悬浊液中加入氢碘酸:Fe(OH)3+3H+=Fe3++3H2O
C.将 10 mL 0.1 mol•L-l HCl溶液与20 mL 0.05 mol•L-l Na3PO4 溶液混合:3H++2 PO43―= H2PO4―+HPO42―
D.向 Mg(HCO3)2溶液中加入过量NaOH 溶液:Mg2++2HCO3―+2OH―=MgCO3↓+CO32―+2H2O
2.(广东省深圳一模)下列说法中,正确的是
A.电解精炼钢时,粗铜中的金、银、锌等形成阳极泥而与铜分离
B.易潮解的试剂都要用带磨口玻璃塞的广口瓶保存
C.氨可将NO2 转化成无毒的物质,是因为氨具有还原性
D.用己知浓度的盐酸滴定锥形瓶中未知浓度的氢氧化钠溶液时,若锥形瓶中原残留有少量蒸馏水,滴定结果将偏低
1.(广东省深圳一模)分类是化学研究中常用的方法。下列分类方法中,不正确的是
A.依据分子组成中含有氢原子的数目,将酸分为一元酸、二元酸等
B.依据有否电子转移,将化学反应分为氧化还原反应和非氧化还原反应
C.依据能量的变化,将化学反应分为放热反应和吸热反应
D.依据组成元素的种类,将纯净物分为单质和化合物
18. (2006年全国)置换反应的通式可以表示为:
单质(1)+化合物(1)=化合物(2)+单质(2)
请写出满足以下要求的3个置换反应的化学方程式:
①所涉及的元素的原子序数都小于20;
②6种单质分属6个不同的主族。
17、(2008年上海)明矾石是制取钾肥和氢氧化铝的重要原料,明矾石的组成和明矾相似,此外还含有氧化铝和少量氧化铁杂质。具体实验步骤如下图所示:
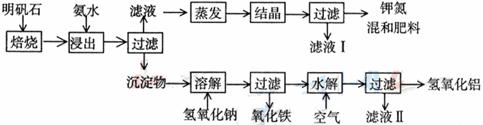
根据上述图示,完成下列天空:
⑴明矾石焙烧后用稀氨水浸出。配制500mL稀氨水(每升含有39.20g氨)需要取浓氨水(每升含有250.28g氨) mL,用规格为 mL量筒量取。
⑵氨水浸出后得到固液混合体系,过滤,滤液中除K+、SO42-外,还有大量的NH4+。检验NH4+的方法是 。
⑶写出沉淀物中所有物质的化学式 。
⑷滤液I的成分是水和 。
⑸为测定混合肥料K2SO4、(NH4)2SO4中钾的含量,完善下列步骤:
①称取钾氮肥试样并溶于水,加入足量 溶液,产生白色沉淀。
② 、 、 (依次填写实验操作名称)。
③冷却、称重。
⑹若试样为mg,沉淀的物质的量为nmol,则试样中K2SO4的物质的量为:
mol(用含m、n的代数式表示)。
16、(2008年重庆)(14分)某学习小组用题27图装置测定铝镁合金中铝的质量分数和铝的相对原子质量。
⑴、A中试剂为_____________________________。
⑵、实验前,先将铝镁合金在稀硝酸中浸泡片刻,其目的是________________________________________。
⑶、检查气密性,将药品和水装入各仪器中,连接好装置后,
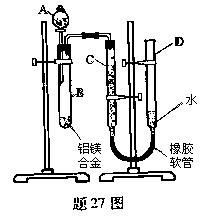 需进行的操作还有:①记录C的液面位置;②将B中剩余固
需进行的操作还有:①记录C的液面位置;②将B中剩余固
体过滤、洗涤、干燥,称重;③待B中不再有气体产生并恢
复至室温后,记录C的液面位置;④由A向B中滴加足量试
剂;⑤检查气密性。上述操作的顺序是__________________
_____________(填序号);记录C的液面位置时,除视线平视
外,还应_________________________。
⑷、B中发生反应的化学方程式为
_____________________________________________;
⑸、若实验用铝镁合金的质量为a g ,测得氢气体积为b mL (已换算为标准状况),B中剩余固体质量为c g,则铝的相对原子质量为____________________。
⑹、实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将___________________(填“偏大”、“偏小”、“不受影响”)。
15.(2007北京卷)(17分)某课外小组对一些金属单质和化合物的性质进行研究。
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
|
实验步骤 |
实验现象 |
|
将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中。 |
产生气泡,析出疏松的红色固体,溶液逐渐变为无色。 |
|
反应结束后分离出溶液备用 |
 |
|
红色固体用蒸馏水洗涤后,置于潮湿空气中。 |
一段时间后固体由红色变为绿色[视其主要成分为Cu2(OH)2CO3] |
按反应类型写出实验中发生反应的化学方程式各一个(是离子反应的只写离子方程式)
置换反应 ;
化合反应 。
(2)用石墨作电极,电解上述实验分离出的溶液,两极产生气泡。持续电解,在阴极附近的溶液中还可以观察到的现象是 。
解释此现象的离子方程式是 。
(3)工业上可用铝与软锰矿(主要成分为MnO2)反应来。
① 用铝与软锰矿冶炼锰的原理是(用化学方程式来表示)
。
② MnO2在H2O2分解反应中作催化剂。若将适量MnO2加入酸化的H2O2的溶液中,MnO2溶解产生Mn2+,该反应的离子方程式是
。
14.(2006年江苏)(5分)把铝、铁混合物1.1 g溶于200 mL 5mol/L盐酸中,反应后盐酸的浓度变为4.6mol/L(溶液体积变化忽略不计).
求:(1)反应中消耗HCl的物质的量.
(2)该混合物中铝、铁的物质的量.
13.(2006年江苏卷)(10分)某化学兴趣小组按照下列方案进行“由含铁废铝制备硫酸铝晶体”的实验:步骤1:取一定量含铁废铝,加足量的NaOH溶液,反应完全后过滤。
步骤2:边搅拌边向滤液中滴加稀硫酸至溶液pH=8-9,静置、过滤、洗涤。
步骤3:将步骤2中得到的固体溶于足量的稀硫酸。
步骤4:将得到的溶液蒸发浓缩、冷却、结晶、过滤、干燥。
请回答以下问题:
⑴上述实验中的过滤操作需要玻璃棒、______________、______________等玻璃仪器。
⑵步骤1过滤的目的是__________________________________________。
⑶当步骤2中的溶液的pH=8-9时,检验沉淀是否完全的方法是______________。
⑷步骤2中溶液的pH较难控制,可改用____________________。
12.(2006年广东卷) (13分) 往有机聚合物中添加阻燃剂,可增加聚合物的使用安全性,扩大其应用范围。例如,在某聚乙烯树脂中加入等质量由特殊工艺制备的阻燃型Mg(OH)2,树脂可燃性大大降低。该Mg(OH)2的生产工艺如下:

⑴精制卤水中的MgCl2与适量石灰乳反应合成碱式氯化镁[Mg(OH)2-xClx·mH2O],
反应的化学方程式为 。
........ ⑵合成反应后,继续在393K-523K下水热处理8h,发生反应:
[Mg(OH)2-xClx·mH2O]==(1-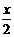 )Mg(OH)2+
)Mg(OH)2+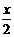 MgCl2+mH2O
MgCl2+mH2O
水热处理后,过滤、水洗。水洗的目的是 。
⑶阻燃型Mg(OH)2具有晶粒大,易分散、与高分子材料相容性好等特点。上述工艺流程中与此有关的步骤是 。
⑷已知热化学方程式:
Mg(OH)2(s)==MgO(s)+H2O(g); △H1=+81.5kJ·mol-1
Al(OH)3(s)=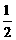 Al2O3(s)+
Al2O3(s)+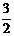 H2O(g); △H2=+87.7kJ·mol-1
H2O(g); △H2=+87.7kJ·mol-1
①Mg(OH)2和Al(OH)3起阻燃作用的主要原因是 。
②等质量Mg(OH)2和Al(OH)3相比,阻燃效果较好的是 ,
原因是 。
⑸常用阻燃剂主要有三类:A.卤系,如四溴乙烷;B.磷系,如磷酸三苯酯;C.无机类,主要是Mg(OH)2和Al(OH)3。从环保的角度考虑,应用时较理想的阻燃剂是 (填代号),理由是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com