
题目列表(包括答案和解析)
13.(广东省韶关市一模)锂电池用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂(LiAlCl4)溶解在亚硫酰氯( 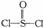 )中形成的,该电池的总反应方程式为:8Li+3SOCl2=6LiCl+
Li2SO3+2S,下列叙述中正确的是
)中形成的,该电池的总反应方程式为:8Li+3SOCl2=6LiCl+
Li2SO3+2S,下列叙述中正确的是
A.电解质溶液中混入水,对电池反应无影响
B.金属锂作电池的负极,石墨作电池的正极
C.电池工作过程中,亚硫酰氯(SOCl2)被还原为Li2SO3
D.电池工作过程中,金属锂提供电子的物质的量与析出硫的物质的量之比为4 :1
26.(广东省韶关市一模)两种硫酸盐按一定比例混合后共熔,可制得化合物X,X溶于水能电离出K+、Cr3+、SO42-,若将2.83 g X中的Cr3+全部氧化为Cr2O72-后,溶液中的Cr2O72-和过量KI溶液反应又生成Cr3+,同时得到3.81gI2;若向溶有2.83 gX的溶液中,加入过量的BaCl2溶液,可得到4.66 g白色沉淀.由此可推断出X的化学式为
A.K2SO4·2Cr2(SO4)3 B.2K2SO4·Cr2(SO4)3
C.K2SO4·Cr2(SO4)3 D.K2SO4·1/2Cr2(SO4)3
25. (广东省韶关市一模)已知反应:(1)C(s)+ O2(g)== CO2(g) △H = -393.5kJ/mol
(广东省韶关市一模)已知反应:(1)C(s)+ O2(g)== CO2(g) △H = -393.5kJ/mol
(2)CO(g)+ O2(g)== CO2(g) △H = -283.0kJ/mol
 则反应:C(s)+ O2(g)== CO(g)的△H
是
则反应:C(s)+ O2(g)== CO(g)的△H
是
A.-221 kJ/mol B.-110.5 kJ/mol C.+110.5 kJ/mol D.+221 kJ/mol
16、(佛山一模)汽车启动电源常用铅蓄电池,放电时的电池反应为:PbO2+Pb+2H2SO4=2PbSO4+2H2O,根据此反应判断下列叙述中正确的是
A. PbO2是电源的负极
B. 负极的电极反应式为:Pb+SO42- -2e- =PbSO4
C. 电池放电时,溶液的pH增大
D. 电池放电时,PbO2得电子,被氧化
13、(佛山一模)一些烷烃的燃烧热如下表:
|
化合物 |
燃烧热/kJ·mol-1 |
化合物 |
燃烧热/kJ·mol-1 |
|
甲烷 |
891.0 |
正丁烷 |
2878.0 |
|
乙烷 |
1560.8 |
异丁烷 |
2869.6 |
|
丙烷 |
2221.5 |
2-甲基丁烷 |
3531.3 |
下列表达正确的是
A. 正戊烷的燃烧热大于3531.3kJ·mol-1
B. 稳定性:正丁烷<异丁烷
C. 乙烷燃烧的热化学方程式为:
2C2H6(g)+7O2(g)=4CO2(g)+6H2O(g) ;△H= -1560.8 kJ·mol-1
D. 相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越多
11、(佛山一模)常温下,下列各组离子在指定环境下能大量共存的是
A. pH=1的溶液中:Na+、K+、SO32-、MnO4-
B. pH=7的溶液中:Na+、Al3+、Cl-、CO32-
C. pH>12的溶液中:Na+、K+、SO42-、AlO2-
D. pH=0的溶液中:Na+、I-、NO3-、ClO-
10、(佛山一模)以下离子方程式正确的是
A. 氧化铁溶于氢碘酸:Fe2O3+6H+ = 2Fe3++3H2O
B. 等物质的量的KHCO3和Ba(OH)2的溶液混合:HCO3-+Ba2++OH- = BaCO3↓+H2O
C. NaHSO3溶液显酸性是因为:HSO3- = SO32-+ H+
D. 硫化钠水溶液呈碱性的原因:S2-+2H2O
 H2S↑+2OH-
H2S↑+2OH-
9、(佛山一模)“化学反应的绿色化”要求原料物质中所有的原子被安全利用且全部转入期望的产品中。下列符合“化学反应的绿色化”的是
A. 实验室制O2
B. 2C2H5OH +
O2 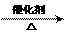 2CH3CHO
+ 2H2O
2CH3CHO
+ 2H2O
C. 2M+N = 2P+2Q,2P+M = Q(M、N为原料,Q为期望产品)
D. 用Fe屑、CuO、稀硫酸为原料制铜:CuO+H2SO4=CuSO4+H2O,Fe+CuSO4=FeSO4+Cu
7、(佛山一模)亚硝酸盐中毒,又名乌嘴病、紫绀病、肠源性青紫病。亚硝酸盐可将正常的血红蛋白氧化成高铁血红蛋白,血红蛋白中的铁元素由二价变为三价,失去携氧能力,使组织出现缺氧现象。美蓝是亚硝酸盐中毒的有效解毒剂。下列说法不正确的是
A. 在中毒过程中血红蛋白被还原 B. 中毒时亚硝酸盐发生还原反应
C. 药品美蓝应具有还原性 D. 解毒时高铁血红蛋白被还原
24.(广东省茂名二模)漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年,亚氯酸不稳定可分解,反应的离子方程式为:5HClO2 = 4 ClO2↑+ H+ +Cl-+2H2O。向NaClO2溶液中滴加H2SO4,开始反应缓慢,随后反应迅速,其原因是( )
A.在酸性条件下,亚氯酸钠的氧化性增强
B.溶液中的H+起催化作用
C.ClO2逸出,使反应的生成物浓度降低
D.溶液中的Cl-起催化作用
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com