
题目列表(包括答案和解析)
26.(揭阳一模)(10分)“氢能”将是未来最理想的新能源。
(1)实验测得,1克氢气燃烧生成液态水时放出142.9 kJ热量,则氢气燃烧的热化学方程式为 :
A.2H2(g) + O2(g) = 2H2O(l); △H = -142.9 kJ·mol-1
B.H2(g) + 1/2O2(g) = H2O(l); △H = -285.8 kJ·mol-1
C.2H2(g) + O2(g) = 2H2O(l); △H = -571.6 kJ·mol-1
D.H2(g) + 1/2O2(g) = H2O(g); △H = -285.8 kJ·mol-1
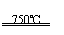 (2)根据“绿色化学”的思想,为了制备H2,某化学家设计了下列反应步骤:
(2)根据“绿色化学”的思想,为了制备H2,某化学家设计了下列反应步骤: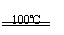
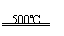 ①CaBr2+H2O CaO+2HBr ②2HBr+Hg HgBr2+H2
①CaBr2+H2O CaO+2HBr ②2HBr+Hg HgBr2+H2
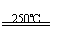 ③HgBr2+CaO
HgO+CaBr2 ④2HgO
2Hg+O2↑
③HgBr2+CaO
HgO+CaBr2 ④2HgO
2Hg+O2↑
你认为该方法的主要缺点是 。
(3)利用核能把水分解制氢气,是目前正在研究的课题。下图是其中的一种流程,其中用了过量的碘,。
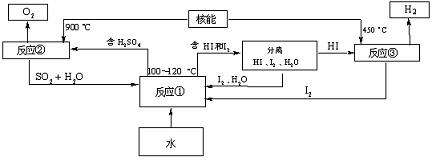
请写出反应①的化学方程式: ;
用此法制取氢气最大的优点是: ;
(4)有人认为目前利用氢气作为能源不太现实。请问你认为是否现实? (填“不现实”或“现实”),说明能够支持你的观点的两点理由:, ;
。
24.(10分)(1)O2+2H2O+4e-=4OH- (1分)
(2)Fe2+,H+;(2分) Cu(1分)
(3)Fe+2H+=Fe2++H2↑(1分) Fe+Cu2+=Fe2+ +Cu (1分)
Fe+2Fe3+=3Fe2+ (1分) (4)38.89% (3分)
24、(揭阳一模)(10分)Cu-Fe合金由于长时间置于空气中表面产生了一层氧化膜(成分为Fe2O3和CuO),现进行如下实验(以下气体体积均在标况下测得)
①将此合金块5.76g置于烧杯中,然后将稀H2SO4逐渐缓慢加入至过量,收集产生的气体为672mL,过滤得绿色溶液A,还有滤渣B。
②将滤渣B投入到一定浓度的HNO3中,完全溶解,得NO、NO2混合气体896mL,经测定(标况下)此混合气体与氢气的相对密度为17。
③将①中所得滤液加入到同浓度足量的HNO3中,用排水法收集一烧瓶气体,再向烧瓶中通入224mLO2,气体恰好完全溶于水。
(1)写出在潮湿空气中合金腐蚀过程的正极电极反应式____________________________
(2)A中存在的阳离子有_____________,B单质为__________________.
(3)①中产生绿色溶液A的离子方程式是______________________________________、
________________________________、______________________________________.
(4)此合金块中铁元素的质量分数为______________________________________。
16.(8分)
(1)①Mg +2OH- -2e- =Mg(OH)2↓(2分)
②Al+4OH--3e-=AlO2-+2H2O(2分)
2H+ +2e- = H2↑(或 2H2O+2e- = H2↑+ 2OH-)(2分)
(2)40Mg+100HNO3=5NO↑+H2↑+NO2↑+3N2↑+4NH4NO3+40Mg(NO3)2+41H2O
16.(张家港二模)(8分)某研究性学习小组对Mg和Al的性质进行了下列的实验及研究。
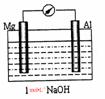 (1)以镁条、铝片为电极,稀NaOH溶液为电解质构成的原电池(如右图所示)时发现,刚开始时,电流表指针向右偏转,镁条做负极;但随后很快指针又向左偏转,镁条表面有极少量的气泡产生。
(1)以镁条、铝片为电极,稀NaOH溶液为电解质构成的原电池(如右图所示)时发现,刚开始时,电流表指针向右偏转,镁条做负极;但随后很快指针又向左偏转,镁条表面有极少量的气泡产生。
①开始阶段,负极发生的反应是_______________ _。
②随后阶段,铝片发生的电极反应式是 ;
则镁电极发生的电极反应式是______ __ _ _____。
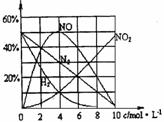 (2)经研究测定,镁与不同浓度的硝酸反应,生成气体产物的含量随HNO3浓度变化曲线如右图所示,溶液中的产物有Mg(NO3)2、NH4NO3和H2O。96mgMg在1L4
mol•L-1的HNO3中完全溶解,并可收集到22.4mL(标准状况下)气体,(忽略反应过程中HNO3浓度的变化,该反应的化学方程式是
。
(2)经研究测定,镁与不同浓度的硝酸反应,生成气体产物的含量随HNO3浓度变化曲线如右图所示,溶液中的产物有Mg(NO3)2、NH4NO3和H2O。96mgMg在1L4
mol•L-1的HNO3中完全溶解,并可收集到22.4mL(标准状况下)气体,(忽略反应过程中HNO3浓度的变化,该反应的化学方程式是
。
0.5 (2分) 0.1(2分)
21.(共11分)
步骤一:正 (1分)。 Cu2++2e = Cu (1分);变小(1分)
3Ag + 4H+ + NO3- = 3Ag+ + NO ↑+ 2H2O(2分)
浓盐酸含有大量氯离子,Au3+ 离子与氯离子形成稳定的AuCl4-离子,使反应2平衡向右移动,则金溶于王水中。(2分)
21、(深圳市宝安区二模)已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不不反应)。某化学兴趣小组在实验室条件下用以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回收和含量测定。
步骤一:电解精制:
请回答以下问题:
电解时,粗铜应与电源的 极相连。阴极上的电极反应式为 ;
电解过程中,硫酸铜的浓度会 (选填:变大、不变、变小);
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:
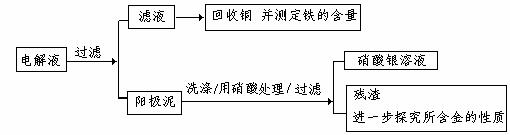
(1)阳极泥的综合利用:
稀硝酸处理阳极泥得到硝酸银稀溶液,请你写出该步反应的离子方程式:
。
残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的知识,以下是他们获取的一些信息:
|
序号 |
反应 |
平衡常数 |
|
1 |
Au
+ 6HNO3(浓)=
Au(NO3)3 + 3NO2↑+ 3H2O |
<< 1 |
|
2 |
Au3+
+ 4Cl- = AuCl4- |
>>1 |
从中可知,金很难与硝酸反应,但却可溶于王水(浓硝酸与盐酸按体积比1∶3的混合物),请你简要解释金能够溶于王水的原因:
(2)滤液含量的测定:
以下是该小组探究滤液的一个实验流程:
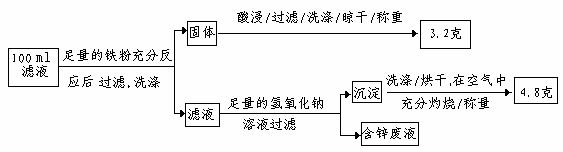
则100ml滤液中Cu2+ 的浓度为 mol·L-1 ,Fe2+的浓度为 mol·L-1。
24、(13分)(1)Na2SO4+Ba(OH)2==2NaOH+BaSO4↓ ………………(2分)
H2SO4+BaCl2==2HCl+BaSO4↓ ………………(1分)
Na2SO4+BaCl2==2NaCl+BaSO4↓ ………………(2分)
(2)H2O+IBr==H++Br-+HIO ……………………(2分)
(3)2I-+ClO-+2H+==I2+Cl-+H2O …………………(2分)
SO32-+I2+H2O==2I-+SO42-+2H- ………………(2分)
ClO->I2>SO32- ………………………………………………(2分)
24、(华附5月月考)(13分)写出下列反应的离子方程式。
(1)试列举出三种不同类别的物质(酸、碱、盐)之间的反应,它们对应的离子方程都可用“Ba2++SO42-==BaSO4↓”来表示,请写出有关反应的化学方程式(3个)_________________。
(2)溴化碘的分子式为IBr,它跟水反应的化学方程式为H2O+IBr==HBr+HIO,若将其改写成离子方程式应为_________________。
(3)在淀粉KI溶液中加入适量稀硫酸,再滴加少量NaClO溶液,溶液即变蓝色,写出该反应的离子方程式__________________。在上述蓝色溶液中滴加足量的Na2SO3溶液,蓝色逐渐消失,写出该反应的离子方程式__________________。从以上实验可知ClO-,I2,SO32-的氧化性由强到弱的顺序是_________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com