
题目列表(包括答案和解析)
24.(江门调研)(10分)从含银、铜、金和铂的金属废料中提取金、银、铂的一种工艺如下:
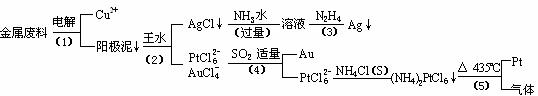
根据以上工艺回答下列问题:
(1)电解时,以金属废料为阳极,纯铜为阴极,CuSO4溶液为电解液,写出电解方程式: 阳极: ,阴极: ;
若工作一段时间后测得导线上通过了3.01×1024个e-,则阴极有 g铜析出。
(2)步骤(4)中SO2被氧化成H2SO4,试写出该步骤的离子反应方程式:
;
(3)金和浓硝酸反应的化学方程式为:Au + 6HNO3(浓) Au(NO3)3
+ 3NO2↑+ 3H2O
Au(NO3)3
+ 3NO2↑+ 3H2O
但该反应的平衡常数很小,所以金和浓硝酸几乎不反应,但金却可以溶于王水,试简要解释之:
。
24.(8分)(1)K=c(CH3OH)/c(CO)·c2(H2) ,减小。(各2分)
(2)0.06 mol·(L·min)-1 (2分)(3)AC(2分)
24.(广东省阳江市一模)(8分) 能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质。一定条件下,在体积为2 L的密闭容器中,1mol一氧化碳与2mol氢气反应生成甲醇(催化剂为Cu2O/ZnO):
CO(g)+2H2(g)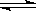 CH3OH(g)
△H<0
CH3OH(g)
△H<0
根据题意完成下列各题:
(1)反应达到平衡时,平衡常数表达式K= ,升高温度,K值 (填“增大”、“减小”或“不变”)。
(2)在500℃,10min反应达平衡,此时甲醇的物质的量浓度为0.3mol/L,从反应开始到平衡,氢气的平均反应速率v(H2)= 。
(3)在其它条件不变的情况下,把反应处于平衡体系的容器的体积压缩为1 L,下列有关该体系的说法正确的是 。
A.氢气的浓度减少 B.正反应速率加快,逆反应速率减慢
C.甲醇的物质的量增加 D.重新平衡时c(CO)/c(CH3OH)不变
25.(11分)(1)(4分)
a.若选①(1分) 在氯化亚铁溶液中加入过量氯水蒸发浓缩后(1分),滴入少量稀盐酸使红棕色溶液变为黄色(1分,消除加热后水解生成的氢氧化铁),然后降温结晶,过滤可得氯化铁固体(1分)a.若选④(1分) 在三氯化铁溶液中加入过量的铁粉(1分),充分反应后过滤(1分),滤液在氯化氢的蒸气中蒸干,可得氯化亚铁固体(1分)(其它正确方案同样给分)
(2)(2分)4OH- 3Cl- (3)(2分)3Zn 4 KOH
(4)(3分)该净水剂在杀菌消毒的过程中被还原为+3价的铁(1分),生成具有强吸附性的氢氧化铁(1分),通过吸附与水中的细微悬浮物共同聚沉,不会象用氯气消毒那样产生有害的含氯物质(1分)。
25.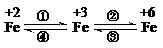 (广东省肇庆一模)(11分)亚铁盐、铁盐、高铁酸盐等铁的重要化合物之间可以相互转化(见右图)。利用转化过程中发生的特征变化,不仅能够实现物质或能量的转化,还用于化学的定性或定量研究。
(广东省肇庆一模)(11分)亚铁盐、铁盐、高铁酸盐等铁的重要化合物之间可以相互转化(见右图)。利用转化过程中发生的特征变化,不仅能够实现物质或能量的转化,还用于化学的定性或定量研究。
已知FeO42-只能在强碱性介质中稳定存在,在酸性介质或水中不稳定:
4FeO42-+20 H+ ==4Fe3+ + 3O2 ↑+10 H2O;4FeO42-+10 H2O== 4Fe(OH)3 ↓+3O2↑ +8 OH-
请利用下列用品:FeCl2溶液(浅绿色)、FeCl3溶液(黄色)、Na2FeO4溶液(紫红色)、铁粉、KSCN溶液、NaOH溶液、NaClO溶液、盐酸、氯水、蒸馏水及必要的实验仪器。完成下列任务:
(1)设计一个实现上述转化①(由FeCl2溶液制FeCl3固体)或④(由FeCl3溶液制FeCl2固体)的实验方案(要求产物纯净),你选择 (填:①或④),其简要实验步骤为:
。
(2)在浓碱中,用NaClO可以实现转化②,请完成这一反应的离子方程式:
3ClO-+ 2Fe(OH)3+ = 2FeO42-+ +5H2O
(3)一种新型高能碱性电池利用了转化③将化学能转化为电能。该电池由电解质(KOH水溶液)、K2FeO4、金属锌及必要的填充材料构成。请完成该电池放电时发生反应的化学方程式:2K2FeO4 + + 8H2O == 2Fe(OH)3 + 3Zn (OH)2 + 。
(4)高铁酸盐是比高锰酸盐更强的氧化剂,它还是一种“绿色、环保、高效” 净水剂,具有很好的杀菌效果、形成絮凝物将水中的悬浮杂质除去。说它是“绿色环保高效” 净水剂的原因是 。
24.(11分)(1)(6分)2Cl- + 2H2O  2OH- + H2↑+ Cl2↑(2分)
2OH- + H2↑+ Cl2↑(2分)
①SiO2(1分) 还原剂 (1分) ②分馏(1分) ③SiCl4 +
2H2  Si
+ 4HCl(1分)
Si
+ 4HCl(1分)
(2)(4分)加成(1分) 加聚(1分) CH2 = CH2 + Cl2 →CH2 Cl - CH2 Cl(1分)

 nCH2 =
CHCl
nCH2 =
CHCl [CH2 – CHCl]n (1分)
[CH2 – CHCl]n (1分)
(3)(1分)盐酸
24.(广东省肇庆一模)(11分)氯碱工业中,通过电解饱和食盐水获得重要的化工原料,其产物中的氯气用途十分广泛,除用于净水、环境消毒外,还用于生产盐酸、聚氯乙烯、氯苯等。
(1电解食盐水的离子方程式为 。氯气用于生产半导体材料硅的流程如下:


①石英砂的主要成分的化学式为 ,在制备粗硅时,焦炭的作用是 。
②粗硅与氯气反应后得到的液态四氯化硅中常混有一些杂质,必须进行分离提纯。其提纯方法为 。
③由四氯化硅得到高纯硅的化学方程式为: 。
(2)用于制造塑料薄膜、人造革、塑料管材和板材的聚氯乙烯(PVC塑料)就是以氯气和乙烯为主要原料通过 、消去和 三步主要反应生产的,这三步的化学方程式分别为: 、CH2Cl---CH2Cl -→CH2 =CHCl +HCl、 。
(3)上述两种生产过程可得到同一种副产品,该副产品是 。
25.(10分)
(1)Cl2 (1分)Br2(1分)6MgO+Br2+5Cl2 == Mg(BrO3)2+5MgCl2(2分)
(如果分步写为两个方程式并正确,各得1分)
(2)Mg(BrO3)2+2KCl == MgCl2+2KBrO3(2分) (3)MgCl2(1分) (4)防止溴酸钾结晶析出(1分)
(5)2KBrO3  2KBr + 3O2↑ (1分) 油炸和烘焙的温度条件不能保证溴酸钾完全分解(1分)
2KBr + 3O2↑ (1分) 油炸和烘焙的温度条件不能保证溴酸钾完全分解(1分)
25.(广东省广州市一模)(10分)
溴酸钾(KBrO3)为白色晶体,是一种常用的氧化剂和分析试剂,加热到370℃分解为溴化钾和氧气。用氯气生产溴酸钾的工艺流程如下:


(1)“合成”过程所发生的反应中,氧化剂是___________,还原剂是___________。反应的化学方程式为______________________________________________________。
(2)“复分解”过程中反应的化学方程式为__________________________________________。
(3)上述流程中第二次过滤的滤渣主要成分是________________。
(4)“趁热过滤”过程中“趁热”的原因是_________________________________________。
(5)溴酸钾具有毒性,食用少量即可引起呕吐和肾脏的损伤。然而美、日等国都允许在油炸薯片中添加一定量溴酸钾,以改善薯片的口感。我国也曾允许用作烘焙面包的添加剂,但已于2005年7月开始全面禁止在食品中使用溴酸钾。2007年,一批来自美国的油炸薯片在珠海口岸被我国有关部门检出含有溴酸钾而被禁止入境。从化学原理分析推测,有关国家认为在油炸薯片中添加溴酸钾是“安全”的理由是(用化学方程式表示)___________________________________________,而我国认为不安全的理由是___________________________________________________________。
20.(共11分)
Ⅰ(1)洗去铝表面的油污(1分), A l2O3+2OH-+3H2O=2Al(OH)4-(2分)或A l2O3+2OH-=2AlO2-+H2O
(2)2 A l +3 H2O-6e = A l2O3+6H+(2分)
(3)ACD(3分,)
Ⅱ 排除氢离子浓度不同对反应的影响,探究氯离子和硫酸根离子对反应的影响。(2分)
氯离子对氧化铝膜有破坏作用,因此铝制容器不有长期盛放含氯离子(食盐)的食品。
(1分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com