
题目列表(包括答案和解析)
25、(广州市调研)(10分)已知高锰酸钾(硫酸酸化)溶液和草酸(H2C2O4)溶液可以发生氧化还原反应。回答下列问题:
(1)该反应中的还原剂是 。
(2)写出该反应的化学方程式 。
(3)反应转移了0.4mol电子,则参加反应的H2SO4物质的量为 mol。
(4)高锰酸钾(硫酸酸化)溶液和草酸溶液的反应可用于测定血钙的含量。方法是:取2mL血液用蒸馏水稀释后,向其中加入足量草酸铵晶体[ 化学式为(NH4)2C2O4],反应生成CaC2O4沉淀,将沉淀用稀硫酸溶解后得到H2C2O4后,再用KMnO4溶液滴定。
①稀硫酸溶解CaC2O4沉淀的化学方程式是 。
②用KMnO4溶液滴定H2C2O4时,判断滴定终点的方法是 。
③若消耗了1.0×10-4mol/L的KMnO4溶液20.00mL,则100mL该血液中的含钙 g。
24.(10分)
(1)四 , VB (2分)
(2)K2O·V2O5·2UO3·3H2O(2分,不必考虑物质的排列顺序)
(3)1、1、1、2、1 (2分) H2C2O4(1分) 0.51(2分)
(4)3V2O5+10Al  6V+5Al2O3(1分)
6V+5Al2O3(1分)
24. (广州市调研)(9分)利用废铁丝、硫酸铜废液(含硫酸亚铁)和被有机物污染的废铜粉制备硫酸铜晶体。生产过程如下:
(广州市调研)(9分)利用废铁丝、硫酸铜废液(含硫酸亚铁)和被有机物污染的废铜粉制备硫酸铜晶体。生产过程如下:
试回答下列问题:
(1)铁丝在投入硫酸铜废液前需用稀H2SO4进行处理,可能发生反应的离子方程式有
。
(2)废铜粉与还原所得铜粉混合灼烧,检验发现灼烧后得到的是CuO和少量Cu的混合物。原因是:
①灼烧不充分Cu未被完全氧化。
②CuO被还原。还原剂是 ,该还原反应的化学方程式是 。
(3)为了使灼烧后的氧化铜混合物充分酸溶,在加入稀H2SO4的同时,还通入O2。通入O2的目的是(用化学反应方程式表示) 。
(4)直接向氧化铜混合物中加入浓硫酸并加热进行酸溶,也可达到充分酸溶的目的,但实际操作中较少使用,原因可能是 。
24.(10分)(1)BC (3分,若只选一个对的得1分,全对得3分)
(2)循环过程需要很高的能量,且使用重金属汞,会产生污染。 (2分)
(3) SO2+I2+2H2O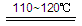 2HI+H2SO4 (2分)
2HI+H2SO4 (2分)
SO2和I2可循环使用,无污染。 (1分)
(4)不现实,理由是现有的制取氢气方法耗能大,制取的成本太高,另外是氢气的熔沸点太低,给储存和运输带来困难。
[或:现实,制取氢气用水为原料,来源丰富;氢气燃烧的产物是水,不会给环境带来任何污染等。(2分)]
24.(惠州二模)(10分)“氢能”将是未来最理想的新能源。
(1)实验测得,1克氢气燃烧生成液态水时放出142.9 kJ热量,则氢气燃烧的热化学方程式为 :
A.2H2(g) + O2(g) = 2H2O(l); △H =-142.9 kJ·mol-1
B.H2(g) + 1/2O2(g) = H2O(l); △H =-285.8 kJ·mol-1
C.2H2(g) + O2(g) = 2H2O(l); △H =-571.6kJ·mol-1
D.H2(g) + 1/2O2(g) = H2O(g); △H = -285.8kJ·mol-1
(2)根据“绿色化学”的思想,为了制备H2,某化学家设计了下列反应步骤:
①CaBr2+H2O
 CaO+2HBr ②2HBr+Hg
CaO+2HBr ②2HBr+Hg
 HgBr2+H2
HgBr2+H2
③HgBr2+CaO
 HgO+CaBr2 ④2HgO
HgO+CaBr2 ④2HgO
 2Hg+O2↑
2Hg+O2↑
你认为该方法的主要缺点是 。
(3)利用核能把水分解制氢气,是目前正在研究的课题。下图是其中的一种流程,其中用了过量的碘,。
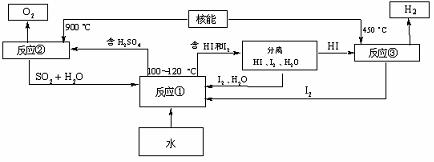
请写出反应①的化学方程式: ;
用法制取氢气最大的优点是: ;
(4)有人认为目前利用氢气作为能源不太现实。请问你认为是否现实? (填“不现实”或“现实”),说明能够支持你的观点的两点理由:, ;
。
23.(本题共10分)(1)2MoS2 + 7O2= 2MoO3 + 4SO2 (2分) ;
SO2(1分) ;回收SO2 再利用 (或回收SO2联合生产硫酸和化肥 2分)
(2)MoO3+2NH3·H2O=2NH + MoO
+ MoO +H2O (2分) ; 不是(1分)
+H2O (2分) ; 不是(1分)
(3)CO(2分)
23.(惠州二模)(10分)钼(元素符号Mo)是银灰色的难熔金属,常见化合价为+6、+5、+4,常温下钼在空气中很稳定,高于600 ℃时很快地氧化生成三氧化钼(MoO3);
辉钼精矿(主要成分为MoS2)是生产钼的主要原料。制取过程包括氧化焙烧,三氧化钼、钼粉和致密钼的制取等主要步骤,工艺流程如图:


(1).辉钼精矿在600℃下进行氧化焙烧 转化为MoO3,同时产生SO2气体。主要反应的化学方程式为: 。钼冶炼厂对大气的污染主要来自于 ,你认为利用并处理该副产物的最好措施是 ;
(2)三氧化钼的制取
将焙砂(主要成分:MoO3)用氨水浸出,与氨水反应生成钼酸铵[(NH4)2MoO4]溶液:反应的离子方程式为: ;
该反应: (填是或不是)氧化还原反应。
将所得钼酸铵[(NH4)2MoO4]溶液加热到55-65 ℃,用盐酸调节至溶液的pH为2,搅拌析出多钼酸铵[(NH4)2O·mMoO3·nH2O]晶体;为除去钙、镁、钠等杂质,将多钼酸铵重新溶于氨水形成钼酸铵,使氨挥发后生成仲钼酸铵晶体[(NH4)2O·7MoO3·4H2O],将仲钼酸铵晶体脱水、煅烧得纯度为99.95%的三氧化钼(MoO3)。
(3)金属钼粉的生产:
工业上在管状电炉中用氢气分两步还原三氧化钼得到钼粉:
① 在450-650℃下: MoO3 + 3H2 === MoO2 + 3H2O
② 在900-950 ℃下:MoO2 + 2H2 === Mo + 2H2O
某同学根据上述还原原理,认为还可用 等还原剂还原MoO3得到钼粉。
25.(10分)(1)1:2 (2分)
(2)3NF3+5H2O=2NO+HNO3+9HF(3分)
(3)产生红棕色气体,产生刺激性气味气体,产生白雾。(各1分)
(4)NaOH 或KOH (2分)
25.(10分)三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3 ,请根据要求回答下列问题:
(1)反应过程中,被氧化与被还原的元素的物质的量之比为_______________。
(2)写出该反应的化学方程式
__________________________________________________________________。
(3)NF3是一种无色、无臭的气体,但一旦NF3在空气中泄漏,还是易于发现。你判断该气体泄漏时的现象是________________________________________________________。
(4)一旦NF3泄漏,可以用 溶液喷淋的方法减少污染。
24.( 10分)
(1)Cu-2e-=Cu2+(2分)、 Cu2+ + 2e-=Cu(2分) 160(2分)
(2)2AuCl4-+3SO2 + 6 H2O =2Au + 8Cl- + 3SO42- + 12H+ (2分)
(3)王水中含有大量的Cl-,Au3+与Cl-可生成AuCl4-,使该平衡中Au3+浓度降低,平衡正移,金即可溶于王水。(2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com