
题目列表(包括答案和解析)
14、(佛山一模)一定温度下,将4molPCl3和2molCl2充入容积不变的密闭容器中,在一定条件下反应:PCl3+Cl2
 PCl5 ,各物质均为气态。达平衡后,PCl5为0.8mol。若此时再移走2molPCl3和1molCl2 ,相同温度下达到平衡,PCl5的物质的量为
PCl5 ,各物质均为气态。达平衡后,PCl5为0.8mol。若此时再移走2molPCl3和1molCl2 ,相同温度下达到平衡,PCl5的物质的量为
A.0.8mol B.0.4mol
C.0.4mol < x < 0.8mol D.< 0.4mol
3.(广东省茂名二模)2HBr 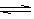 Br2+H2,在四种不同的条件下进行,Br2、H2起始的浓度为0,反应物HBr的浓度(mol/L)随反应时间(min)的变化情况如下表:
Br2+H2,在四种不同的条件下进行,Br2、H2起始的浓度为0,反应物HBr的浓度(mol/L)随反应时间(min)的变化情况如下表:
|
实验序号 |
实验温度 |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
|
1 |
800℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.5 |
0.5 |
0.5 |
|
2 |
800℃ |
C2 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
|
3 |
800℃ |
C3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
|
4 |
820℃ |
1.0 |
0.40 |
0.25 |
0.20 |
0.20 |
0.20 |
0.20 |
下列说法正确的是( )
A.实验2,HBr的初始浓度C2=1.0 mol/L
B.从上表数据分析,2HBr 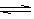 Br2+H2正反应为放热反应
Br2+H2正反应为放热反应
C.实验4一定使用了催化剂
D.实验3的反应速率大于实验1的反应速率
2.(广东省梅州一模)已知298K时, N2(g)+3H2(g)=2 NH3(g);△H=-92.4kJ/mol, 在相同条件下,向密闭容器中加入1molN2和3molH2,达到平衡时放出的热量为Q1,向另一容积相同的密闭容器中通入0.95molN2、2.85molH2和0.1molNH3,达到平衡时放出的热量为Q2,则下列关系式正确的是 ( )
A.Q1 = Q2 = 92.4kJ B.Q2 < Q1 = 92.4kJ
C.Q2< Q1< 92.4kJ D.Q2 = Q1 < 92.4kJ
1.(广东省梅州一模)下列有关实验的叙述中,正确的有: ( )
①蒸干AlCl3溶液可得纯净的无水氯化铝;②试管里加入少量淀粉,再加入一定量稀硫酸,加热3-4分钟,然后加入银氨溶液,片刻后管壁上有“银镜”出现;③无法用分液漏斗将甘油和水的混合液体分离;④用酸式滴定管量取20.00mL高锰酸钾酸性溶液;⑤为了测定某溶液的pH,将未经湿润的pH试纸浸入到待测溶液,过一会取出,与标准比色卡进行对比;⑥配制银氨溶液时,将稀氨水慢慢滴加到硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止。
A.③④ B.②⑤ C.④⑥ D.①⑤
26.(广东省深圳一模)(12 分 )
金属腐蚀造成很大的经济损失,甚至超过自然灾害,其中钢铁锈蚀最为严重,寻求防止钢铁腐蚀的方法意义重大。
(1)钢铁的表面发蓝、发黑处理是常用的防腐方法。下列反应是主要反应之一。
请配平方程式:口 Na2FeO2+ 口 NaNO2+ 口 = 口 NaFeO2+ 口 NH3↑+ 口 NaOH
(2)钢铁的“钝化”处理也能达到防腐目的,经冷、浓 HNO3 处理后,其表面有一层致密氧化物保护膜,但是加热或在稀 HNO3中 就不能 “钝化”。不同浓度的 HNO3 与铁反应的还原产物很复杂,其分布曲线如图。
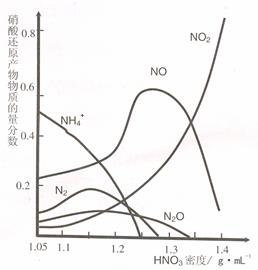 ①图示可知,密度为 1.05g·mL-1 的硝酸与铁反应时,其最多的还原产物是 ;密度大于1.35 g·mL-1的硝酸与铁反应时,其还原产物主要是 NO2;分析HNO3 与铁反应的规律是:
①图示可知,密度为 1.05g·mL-1 的硝酸与铁反应时,其最多的还原产物是 ;密度大于1.35 g·mL-1的硝酸与铁反应时,其还原产物主要是 NO2;分析HNO3 与铁反应的规律是:
。
② mg 铁与含 n g HNO3的硝酸溶液恰好完全反应,若硝酸的还原产物只有 NO, 则 m 的取值可能是 (填字母编号 )
A.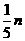 B.
B.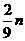 C.
C.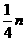 D.
D.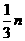 E.
E.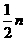
③工业上一般不用冷浓硝酸进行铁表面处理,其可能的原因是: 。
(3)金属 (M) 的腐蚀是因为发生反应: M-ne-→Mn+,除了上述表面处理的方法外,下列方法也能起到防腐作用的是 (填字母编号)
A.在铁中掺入铭、镇等金属,改变其内部结构,制成不锈钢
B.在铁制品表面镀辞
C.提高铁中含碳量,制成生铁
D.将水库铁闸门与直流电源的负极相连
26(11分)(1)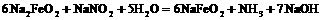 (2分)
(2分)
(2)①NH3 或NH4+ (1分);其规律是:硝酸的浓度越大,其还原产物中氮元素化合价越高。(2分)
(其它合理答案均给分。如硝酸的浓度越大,气体生成物中二氧化氮的含量越高;或者,只在硝酸浓度较低时,产物中才会出现氮气。等等)
②B、C、D (对一个或两个给一分,全对2分,但只要出现A、E便不给分) (2分)
③硝酸易挥发,且不稳定,见光易分解,故不易操作;生成物对环境污染严重 (2分)
(3)A.B.D.(2分)(对一个或两个给一分,全对2分,但只要出现C便不给分)
26. (共12分)
(1) MnSO4 (1分)
(2)增大溶液的pH,使Fe3+和 Al3+生成沉淀; (1分)
使形成胶体的氢氧化铝和氢氧化铁也生成沉淀;(1分) H2SO4 (1分)
(3) Fe2O3、Al2O3、S (各1分)
(4)纯碱 、H2SO4 (各1分) (5)降温结晶 (1分) (6)1.03(或1)(2分)
26、(佛山一模)(12分)
某工厂用软锰矿(含MnO2约70%及Al2O3)和闪锌矿(含ZnS约80%及FeS)
共同生产MnO2和Zn(干电池原料):
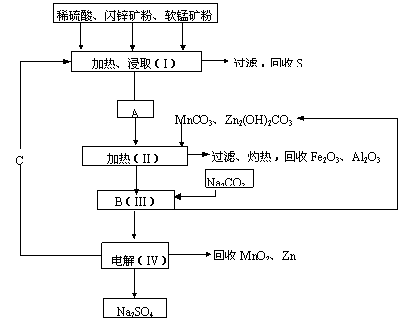

已知① A是MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液。
② IV中的电解反应式为MnSO4+ZnSO4+2H2O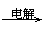
 MnO2+ Zn+2H2SO4。
MnO2+ Zn+2H2SO4。
(1)A中属于还原产物的是__________ ______。
(2)MnCO3、Zn2(OH)2CO3的作用是 ;II需要
加热的原因是 ;C的化学式是___________________。
(3)该生产中除得到MnO2和Zn以外,还可得到的副产品是_______________________。
(4)如果不考虑生产中的损耗,除矿石外,需购买的化工原料是___________。
(5)要从Na2SO4溶液中得到芒硝(Na2SO4·10H2O),需进行的操作有蒸发浓缩、
________、过滤、洗涤、干燥等。
(6)从生产MnO2和Zn的角度计算,软锰矿和闪锌矿的质量比大约是__________。
23.(10分)(1)Cu+H2O2+2HCl = CuCl 2+ 2H2O (1分)
作图:以铜为阳极,以盐酸为电解质溶液的电解池装置。(2分)
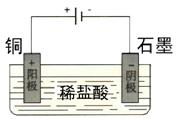
(2)大于(1分);可行(1分)
(3)不同意(1分);等质量的铜片与等体积、过量的浓硝酸、稀硝酸反应,所得溶液中Cu2+的浓度基本相等;(1分)
将一定量的NO2通入铜片与稀硝酸反应后的溶液中,若溶液呈绿色,则该同学的结论正确,反之,不正确。(3分)(其他合理答案也给分)
23、(佛山一模)(10分)
盐酸、硫酸和硝酸是中学阶段常见的“三大酸”。请就“三大酸”与金属铜反应的情况,回答下列问题:
(1)我们知道,稀盐酸与铜不反应,但向稀盐酸中加入H2O2后,则可使铜溶解。该反应的化学方程式为 。
 某同学未加入氧化剂,而是设计了一个实验装置,也能使铜很快溶于稀盐酸。请在方格中画出该装置:
某同学未加入氧化剂,而是设计了一个实验装置,也能使铜很快溶于稀盐酸。请在方格中画出该装置:
(2)在一定体积的18 mol·L-1的浓硫酸中加入过量的铜片,加热使之反应,被还原的硫酸是0.9mol,则该硫酸的实际体积 (填大于、等于或小于)100mL。
有同学提出:若使剩余的铜片继续溶解,可向其中加入硝酸盐,可行吗? (填“可行”或“不可行”)
(3)将等质量的铜片分别与等体积、过量的浓硝酸和稀硝酸反应,所得到的溶液前者呈绿色,后者呈蓝色,某同学提出可能是Cu2+浓度不同引起的,你同意这种看法吗?
(填“同意”或“不同意”),原因是 。
另一同学提出溶液呈“绿色”是溶液中Cu2+与NO2共存的结果,请你设计实验探究此说法正确与否,请简述实验方案、实验现象及由此得出的结论:
。
25.(10分)
(1)等于(2分); (2)90%(2分); (3)大于(2分); (4)1.7a(2分);将活塞向左推 (2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com