
题目列表(包括答案和解析)
24.(12分)
(1)化肥、有机化工(染料、制药、照相材料、颜料、塑料、合成纤维)或者国防工业(炸药);(1分,写对其中一个即可)
(2)①增大压强 t2-t3 (各1分,共2分) ②4/a2 (3分)
(3)4NH3+5O2 4NO+6H2O,减小。(2+1=3分)
4NO+6H2O,减小。(2+1=3分)
(4)2NO2+Na2CO3=NaNO3+NaNO2+CO2 氮气(2+1=3分)
0.5L密闭容器中,充分反应后测得N2的转化率为50﹪。则该反应的化学平衡常数的数值为 。
(3)氨催化氧化的化学方程式为_________________________,该反应是放热反应,当温度升高时,反应的化学平衡常数K值____(增大、减小、无影响)。
(4)今年“两会”后,党和国家更加重视环保。工业上常用纯碱溶液来吸收硝酸厂尾气中的二氧化氮,吸收产物中有亚硝酸钠、硝酸钠和二氧化碳,该化学方程式为__________;还可以利用氢气在催化剂下把氮的氧化物还原为_____ 和水。
24、(佛山二模)(12分)工业生产硝酸的流程图如下


请回答下列问题:
(1)写出硝酸在工农业生产中的重要作用_______________________(任写一条)。
(2)已知N2(g) +3H2(g)  2NH3(g) ; ΔH=-92.4kJ·mol-1。请回答:
2NH3(g) ; ΔH=-92.4kJ·mol-1。请回答:
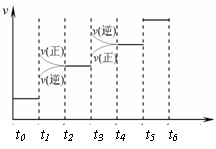 ① 当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如右图所示。图中tl 时引起平衡移动的条件可能是
。
① 当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如右图所示。图中tl 时引起平衡移动的条件可能是
。
其中表示平衡混合物中NH3的含量最高的一段时间是 。
②温度为T ℃时,将2a mol H2和a mol N2放入
23.(13分) (1)B(2分) (2)HgBr2+CaO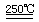 HgO+CaBr2(1分) 循环过程需要很高的能量,且使用重金属汞,会产生污染。(2分) (3)①:SO2+O2+2H2O
HgO+CaBr2(1分) 循环过程需要很高的能量,且使用重金属汞,会产生污染。(2分) (3)①:SO2+O2+2H2O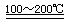 2HI+H2SO4(1分) ②:2H2SO4
2HI+H2SO4(1分) ②:2H2SO4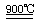 2SO2↑+O2↑+2H2O (1分) SO2和I2
可循环使用,无污染。(1分) (4)①<(1分) ②:加快;增大(2分) ③:Cu2O+CO
2SO2↑+O2↑+2H2O (1分) SO2和I2
可循环使用,无污染。(1分) (4)①<(1分) ②:加快;增大(2分) ③:Cu2O+CO Cu+CO2
(2分 不写可逆号扣1分)
Cu+CO2
(2分 不写可逆号扣1分)
20.(湛江二模)(13分)“氢能”将是未来最理想的新能源。
(1)实验测得,1g氢气燃烧生成液态水时放出142.9kJ热量,则氢气燃烧的热化学方程式为___________________________。(填序号)
A.2H2(g)+O2(g)  2H2O(l);△H=-142.9kJ·mol-1
2H2O(l);△H=-142.9kJ·mol-1
B.H2(g)+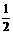 O2(g)
O2(g)  H2O(l);△H=-285.8kJ·mol-1
H2O(l);△H=-285.8kJ·mol-1
C.2H2+O2 2H2O(l);△H=-571.6kJ·mol-1
2H2O(l);△H=-571.6kJ·mol-1
D.H2(g)+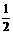 O2(g)
O2(g)  H2O(g);△H=-285.8kJ·mol-1
H2O(g);△H=-285.8kJ·mol-1
(2)某化学家根据“原子经济”的思想,设计了如下制备H2的反应步骤
①CaBr2+H2O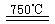 CaO+2HBr ②2HBr+Hg
CaO+2HBr ②2HBr+Hg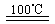 HgBr2+H2
HgBr2+H2
③HgBr2+_____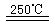 _____ ④2HgO
_____ ④2HgO 2Hg+O2↑
2Hg+O2↑
⑤2H2 +O2 2H2O
2H2O
请你根据“原子经济”的思想完成上述步骤③的化学方程式:________________________。并根据“绿色化学”的思想评估该方法制H2的主要缺点:__________________________。
(3)利用核能把水分解制氢气,是目前正在研究的课题。下图是其中的一种流程,其中用了过量的碘。


完成下列反应的化学方程式:反应①______________;反应②________________________。此法制取氢气的最大优点是_____________________________。
(4)目前有科学家在一定条件下利用水煤气(CO+H2)合成甲醇:
CO(g)+2H2(g)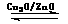 CH3OH(g)。甲醇的物质的量与反应温度的关系如下图所示:
CH3OH(g)。甲醇的物质的量与反应温度的关系如下图所示:
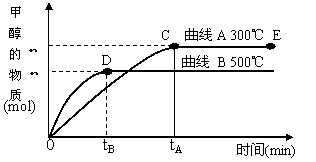

①合成甲醇反应,其反应热△H______0。(填“>”、“<”或“=”)
②其它条件不变,对处于E点的体系体积压缩到原来的1/2,正反应速率加快,逆反应速率_________。(填“加快”、“减慢”、“不变”)重新平衡时c(CH3OH)/c(CO)_________。(填“增大”、“减小”或“不变”)
③据研究,合成甲醇反应体系中通入少量CO2有利于维持催化剂Cu2O的量不变,原因是(用化学方程式表示)_______________________________________。
24.(8分)(1)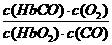 (1分)(2)呼吸新鲜的空气(1分)
(1分)(2)呼吸新鲜的空气(1分)
(3)HbO2+CH3CH(OH)COOH+CO2 Hb(H+)CO2+O2+CH3CH(OH)COO-(2分)
Hb(H+)CO2+O2+CH3CH(OH)COO-(2分)
(4)吸(1分)。因为温度升高时平衡向右移动(2分)(5)B(1分)
24.(汕头二模)(8分)人体中的血红蛋白(简写为Hb)可以携带氧气变为氧合血红蛋白(简写为HbO2)。CO可与HbO2反应生成HbCO,并且HbCO比HbO2要稳定得多,其化学平衡方程式可写为:HbO2+CO HbCO+O2(Kc=2.1×102)
HbCO+O2(Kc=2.1×102)
(1)上述平衡的化学平衡常数表达式为Kc=________________________。
(2)HbCO的形成使得血红蛋白不再携带氧气而造成人员中毒。一旦发生CO中毒,首要做的事是让患者_____________________________________________________。
(3)除了CO和O2,HbO2还可以吸附CO2和氢离子,且反应几乎是完全的。方程式如下:
HbO2+H++CO2 Hb(H+)CO2+O2
Hb(H+)CO2+O2
人体在肌肉剧烈运动时会产生乳酸(CH3CH(OH)COOH),乳酸在血液中会和氧合血红蛋白发生的反应为: 。
(4)肌肉剧烈运动时放出大量的热量,氧合血红蛋白会放出更多氧气,你认为乳酸和氧合血红蛋白的反应是______热反应(填“吸”或“放”)。简述理由:
。
(5)已知在人体温度时,乳酸的电离平衡常数Ka是1.0×10-3,体液的pH是7.4,推断在肌肉组织中生成的乳酸,主要是以_______形式存在。(填字母代号)
A.分子形式 B.乳酸根离子
23.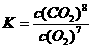 (1)①
(1分) A、B、C(只选A、C得1分,全对得2分)
(1)①
(1分) A、B、C(只选A、C得1分,全对得2分)
②NaA1O2[或NaA1(OH)4]、Na2SiO3 (各1分,共2分)
③除去A1O-2、SiO32-等杂质(1分)
④2CrO42-+2H+=Cr2O72-+H2O(1分)
(2)(6分)
|
② |
蒸发 |
将所得溶液转移至蒸发皿中,加热蒸发溶液,使NaC1结晶析出 |
|
③ |
过滤 |
趁热过滤,将NaC1晶体与溶液分离 |
|
④ |
冷却,结晶 |
冷却滤液使K2Cr2O7结晶析出 |
23.(揭阳一模)(13分)红矾钠(重铬酸钠:Na2Cr2O7·2H2O)是重要的基本化工原料,在印染工业、电镀工业和皮革工业中作助剂,在化学工业和制药工业中也用作氧化剂,应用领域十分广泛。
(1)实验室中红矾钠可用铬铁矿(主要成分:FeO·Cr2O3)利用以下过程来制取。
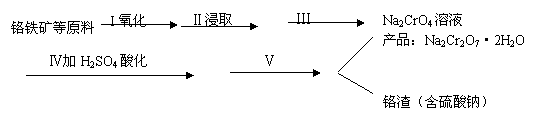

①步骤I中反应的化学方程式为:
 该反应的化学平衡常数的表达式为
,在常温下该反应速度极慢,下列措施中能使反应速率增大的是
。
该反应的化学平衡常数的表达式为
,在常温下该反应速度极慢,下列措施中能使反应速率增大的是
。
A.升高温度 B.通入过量的空气 C.将原料粉碎 D.增加纯碱的用量
②步骤Ⅱ中所得溶液显碱性,其中除含有Na2CrO4外还含有铝、硅元素的化合物,它们的化学式可能是 、 。
③步骤Ⅲ需将溶液的pH调至7~8并煮沸,其目的是 。
④步骤Ⅳ中发生反应的离子方程式为: 。
(2)将红矾钠与KCl固体按1:2(物质的量比)混合溶于水后经适当操作可得到K2Cr2O7晶体。请填写表中空格,完成上述过程。(已知:在室温下重铬酸钾溶解度很小,而在升高温度时,其溶解度大大增加)。
|
序号 |
实验步骤 |
简述实验操作(不必叙述如何组装实验装置) |
|
① |
溶解 |
将混合物放入烧杯中,加入热的蒸馏水,充分搅拌直到固体不再溶解。 |
|
② |
|
|
|
③ |
|
|
|
④ |
|
|
|
⑤ |
过滤、干燥 |
得到K2Cr2O7晶体 |
24.(13分)
(1)(5分)①(4分)<(1分) 在1atm和298K条件下,1mol氮气和3mol氢气完全反应生成2mol氨气,放出92.4kJ热量(1分),该反应为可逆反应,反应物不能全部变为生成物(1分);又因为反应温度为500℃,所以放出的热量小于92.4kJ(1分);
②(1分)CEF(答2个且正确者得0.5分;全对得1分;多1个错误答案扣0.5分,扣完为止)。
|
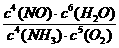 (1分)
(1分)
减小(1分) [讲评时要学生说原因:因为氨的催化氧化反应是放热反应,所以升高温度K会减小]
(3)(4分)
设充入气体总量为1mol,氮气为xmol,则氢气为(1-x)mol。
则有: 28x+2(1-x)=8.5(或用十字交叉法)
解得:N2:x=0.25mol H2:1mol-0.25mol=0.75mol………….…………..…..(1分)
又设平衡时N2转化ymol,则:
N2 + 3H2  2NH3
2NH3
起始 0.25mol 0.75mol 0
变化 y mol 3ymol 2ymol
平衡 (0.25-y)mol (0.75-3y)mol 2ymol…………..……….…………….…..(1分)
则有: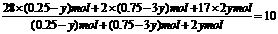 解得:y=0.075mol
…..…..(1分)
解得:y=0.075mol
…..…..(1分)
则氢气的转化率为: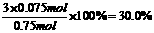 …………..………………………….(1分)
…………..………………………….(1分)
(其它合理解法参照给分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com