
题目列表(包括答案和解析)
24.(9分) (1) 0.03 (2)丁>乙>甲>丙 (3)不;右 (4)D
(5)c=3b;a≥0 (6)0.9<c≤4.5
24.(汕头一模)(9分) 向体积为2 L的固定密闭容器中通入3molX气体,在一定温度下发生如下反应:
2X(g) 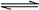 Y(g)+3Z(g)
Y(g)+3Z(g)
(1)经5min 后反应达到平衡 , 此时测得容器内的压强为起始时的1.2倍, 则用Y表示的速率为 mol/(L·min)。
(2)若上述反应在甲、乙、丙、丁四个同样的密闭容器中进行,在同一段时间内测得容器内的反应速率分别为:甲:v(X)=3.5 mol/(L·min);乙:v(Y)=2 mol/(L·min);丙:v(Z)=4.5mol/(L·min);丁:v(X)=0.075 mol/(L·s)。若其它条件相同,温度不同,则温度由高到低的顺序是(填序号) 。
(3)若向达到(1)的平衡体系中充入氮气,则平衡向 (填"左"或"右"或"不)移动;若向达到(1)的平衡体系中移走部分混合气体,则平衡向 (填“左”或“右”或“不”)移动。
(4)若在相同条件下向达到(1)所述的平衡体系中再充入0.5molX气体 , 则平衡后X 的转化率与(1)的平衡中X的转化率相比较:
A.无法确定 B.前者一定大于后者
C.前者一定等于后者 D.前者一定小于后者
(5)若保持温度和压强不变,起始时加入X、Y、Z物质的量分别为a mol、b mol、c mol, 达到平衡时仍与(1)的平衡等效,则:a、b、c应该满足的关系为 。
(6)若保持温度和体积不变,起始时加入X、Y、Z 物质的量分别为a mol、b mol、c mol, 达到平衡时仍与(1)的平衡等效,且起始时维持化学反应向逆反应方向进行,则c的取值范围应该为 。
21.(14分)(1) ①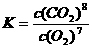 ; C ②NaA1O2 、Na2SiO3
; C ②NaA1O2 、Na2SiO3
③除去A1O2-、SiO32-等杂质 ④2CrO42-+ 2H+ == Cr2O72-+ H2O
(2)
|
② |
蒸发 |
将所得溶液转移至蒸发皿中,加热蒸发溶液,使NaC1结晶析出。 |
|
③ |
过滤 |
趁热过滤,将NaC1晶体与溶液分离。 |
|
④ |
冷却,结晶 |
冷却滤液使K2Cr2O7结晶析出。 |
21.(汕头一模)(14分)红矾钠(重铬酸钠:Na2Cr2O7·2H2O)是重要的基本化工原料,在印染工业、电镀工业和皮革工业中作助剂,在化学工业和制药工业中也用作氧化剂,应用十分广泛。
(1)实验室中红矾钠可用铬铁矿(主要成分:FeO·Cr2O3)利用以下过程来制取。
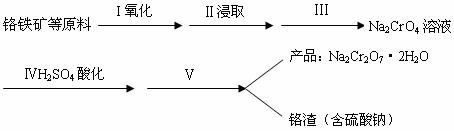
①步骤I中反应的化学方程式为:
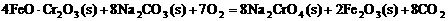
该反应的化学平衡常数的表达式为 ,在常温下该反应速度极慢,下列措施中不能使反应速率增大的是 。
A.升高温度 B.将原料粉碎
C.增加纯碱的用量 D.通入过量的空气
②步骤Ⅱ中所得溶液显碱性,其中除含有Na2CrO4外还含有铝、硅元素的化合物,它们的化学式可能是 、 。
③步骤Ⅲ需将溶液的pH调至7~8并煮沸,其目的是 。
④步骤Ⅳ中发生反应的离子方程式为: 。
(2)将红矾钠与KCl固体按1:2(物质的量之比)混合溶于水后经适当操作可得到K2Cr2O7晶体。请填写表中空格,完成上述过程。
|
序号 |
实验步骤 |
简述实验操作(不必叙述如何组装实验装置) |
|
① |
溶解 |
将混合物放入烧杯中,加水,充分搅拌直到固体不再溶解。 |
|
② |
|
|
|
③ |
|
|
|
④ |
|
|
|
⑤ |
过滤、干燥 |
得到K2Cr2O7晶体。 |
21.(8分)
(1)与实验②作对照,证明起防火作用的是Na2SiO3而不是水。(2分)
(2)(6分,每空1分) ①反应时间,min(或s) ②生成氢气的体积,L(或mL)
(或锌粒的质量减少,g;或H+的浓度变化,mol·L-1;或其他合理答案)
H2,L·min-1 (或Zn,g·min-1;或Zn,mol·min-1;或H2SO4,mol·L-1·min-1或其他合理答案)
21.(广东省广州市一模)(8分)
(1)实验Ⅰ:证明Na2SiO3具有防火性能。
取两个相同的小木条,分别放入蒸馏水和Na2SiO3饱和溶液中,使之充分吸湿、浸透,取出稍沥干(不再滴液)后,同时分别放置在酒精灯外焰处。观察到的现象如下表:
|
编号 |
实验 |
现象 |
|
① |
放入蒸馏水 |
木条燃烧 |
|
② |
放入Na2SiO3饱和溶液 |
木条不燃烧 |
设计实验①的目的是 。
(2)实验Ⅱ:测定锌与稀硫酸反应的速率。
测定该反应速率的方法有多种,不同的方法需要测定不同的数据。请根据你设计的测定方法,填写需要记录的数据及其单位:
① ,单位 ;
② ,单位 。
根据你测定的实验数据,处理后可求得_________(填化学式)的反应速率,单位是__________。
26.(11分)
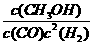 (1)BD(2分)(选对1个给1分,选错1个倒扣1分,但不出现负分。)
(1)BD(2分)(选对1个给1分,选错1个倒扣1分,但不出现负分。)
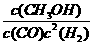 (2)C (1分) 该反应达到平衡时,平衡常数K=增大容器体积时,c(CH3OH)和c(CO)等比例减小,由于H2浓度不变,此时的值仍然等于K,所以平衡不移动。(2分)
(2)C (1分) 该反应达到平衡时,平衡常数K=增大容器体积时,c(CH3OH)和c(CO)等比例减小,由于H2浓度不变,此时的值仍然等于K,所以平衡不移动。(2分)
(3)越高(1分)
原料气含少量CO2有利于提高生成甲醇的碳转化率,CO2含量过高碳转化率又降低且有甲烷生成。(2分)
(4)温度 压强 CO和H2的体积分数之比 (每空1分)
26.(广东省广州市一模)(11分)
甲醇(CH3OH)是一种重要的化工原料,合成甲醇的主要反应为:
CO(g)+2H2(g) CH3OH(g) ΔH
< 0。
CH3OH(g) ΔH
< 0。
Ⅰ.在一定条件下,上述反应在一密闭容器中达到平衡。
(1)体积不变的条件下,下列措施中有利于提高CO的转化率的是 _______(填字母)。
A.升高温度 B.增大压强 C.通入CO D.通入H2
(2)在保证H2浓度不变的情况下,增大容器的体积,平衡____________(填字母)。
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
作出此判断的理由是_____________________________________________________
______________________________________________________________________。
Ⅱ.原料气的加工过程中常常混有一定量CO2,为了研究不同温度下CO2对该反应的影响,以CO2、CO和H2的混合气体为原料在一定条件下进行实验,结果表明,原料气各组分含量不同时,反应生成甲醇和副产物甲烷的碳转化率是不相同的。实验数据见下表:
|
CO2%-CO%-H2% (体积分数) |
0–30–70 |
2–28–70 |
4–26–70 |
8–22–70 |
20–10–70 |
|||||||||||
|
反应温度/℃ |
225 |
235 |
250 |
225 |
235 |
250 |
225 |
235 |
250 |
225 |
235 |
250 |
225 |
235 |
250 |
|
|
碳转化率(%) |
CH3OH |
4.9 |
8.8 |
11.0 |
36.5 |
50.7 |
68.3 |
19.0 |
33.1 |
56.5 |
17.7 |
33.4 |
54.4 |
8.0 |
12.0 |
22.6 |
|
CH4 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
2.8 |
2.8 |
2.8 |
(3)由上表数据可得出多个结论。
结论一:在一定条件下,反应温度越高,碳转化率__________。
结论二:______________________________________________________________
__________________________________________________________________。
(4)为了验证结论二,有科学家又用以下五组不同组成的原料气再次进行实验。
|
组别 |
体积分数(%) |
|||
|
CO |
CO2 |
H2 |
N2 |
|
|
第1组 |
19.7 |
0.0 |
59.1 |
21.2 |
|
第2组 |
20.7 |
0.3 |
62.1 |
16.9 |
|
第3组 |
16.9 |
1.3 |
50.7 |
31.1 |
|
第4组 |
19.8 |
5.5 |
59.4 |
15.3 |
|
第5组 |
20.3 |
10.9 |
60.9 |
7.9 |
进行该验证实验时,控制不变的因素有________________、_________________、____________________________________________等。
26.(10分)
(1)①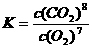 (2分)
(2分)
②t2 时对平衡体系降温 (2分) b(1分)
(2)NaA1O2[或NaA1(OH)4]、Na2SiO3(各1分,共2分)
①除去A1O2、SiO32-等杂质(1分)
②2CrO42-+2H+=Cr2O72-+H2O(2分)
26.(广东佛山市南海区调研)(10分)红矾钠(重铬酸钠:Na2Cr2O7·2H2O)是重要的基本化工原料,在印染工业、电镀工业和皮革工业中作助剂,在化学工业和制药工业中也用作氧化剂,应用领域十分广泛。
(1)实验室中红矾钠可用铬铁矿(主要成分:FeO·Cr2O3)利用以下过程来制取。
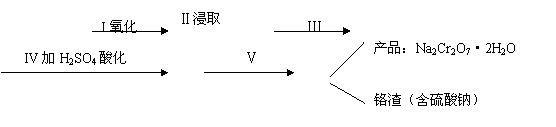
 铬铁矿等原料
Na2CrO4溶液
铬铁矿等原料
Na2CrO4溶液
①步骤I中反应的化学方程式为:
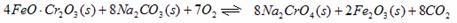 △H<0
△H<0
该反应的化学平衡常数的表达式为 。
②图1、图2表示该反应在t1时达到平衡、在t2时因改变某个条件而发生变化的曲线:
由图1判断,反应进行至t2 min时,曲线发生变化的原因是
(用文字表达)。由图2判断,t2 min到t3 min 的曲线变化的原因可能是 (填编号)
a.升高温度 b.加了催化剂 c.将原料粉碎 d.缩小容器体积

(2)步骤Ⅱ中所得溶液显碱性,其中除含有Na2CrO4外还含有铝、硅元素的化合物,它们的化学式可能是 、 。
①步骤Ⅲ需将溶液的pH调至7~8并煮沸,其目的是 。
②步骤Ⅳ中发生反应的离子方程式为: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com