
题目列表(包括答案和解析)
7.在一个密闭容器中盛有11 g X气体(X的摩尔质量为44 g·mol-1)时,压强为1×104 Pa。如果在相同条件下,把更多的气体X充入容器,使容器内压强增至5×104Pa,这时容器内气体X的分子数均为
A.3.3×1025 B.3.3×1024
C.7.5×1023 D.7.5×1022
6.设阿伏加德罗常数为NA,标准状况下某种O2和N2的混合气体m g,含有b个分子,则n g该混合气体在相同状况下所占的体积(L)应是
A.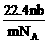 B.
B.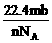 C.
C.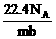 D.
D.
5.某固体仅由一种元素组成,其密度为5 g·cm-3。用X射线研究该固体,结果表明:在棱长为1×10-7cm的立方体中含有20个原子,则此元素的相对原子质量最接近
A.32 B.65 C.120 D.150
4.设NA为阿伏加德罗常数的值,下列有关叙述正确的是
A.标准状况下,1 L庚烷完全燃烧后,所生成的气态产物的分子数为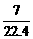 NA
NA
B.1 mol碳正离子CH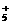 所含的电子总数为10NA
所含的电子总数为10NA
C.13 g锌跟足量稀硫酸反应,置换出的氢气分子数为0.2NA
D. 0.5 mol 1,3丁二烯分子中含有的C==C双键为0.5 NA
3.下列说法正确的是(NA表示阿伏加德罗常数的值)
A.标准状况下,22.4 L以任意比混合的氢气和甲烷的混合物所含的分子数为2NA
B.常温常压下,1 mol氦气含有的核外电子数为4NA
C.4 g金属钙变成钙离子时失去的电子数目为0.2 NA
D.32 g氧气所含有的原子数目为NA
2.设NA代表阿伏加德罗常数的值,下列说法正确的是
A.1.8 g铵离子所含的电子数为1.1 NA
B.1 mol辛烷分子中所含共价键数为25 NA
C.一定温度和压强下某气体的体积约为22.4 L,则此体积为气体摩尔体积
D.在电解食盐水的实验中,测得电解后溶液的pH为14,又知电解后溶液总体积为1 L,即阴极析出的气体的分子数为0.5 NA
1.(2002年上海高考题)NA为阿伏加德罗常数,下述正确的是
A.80 g硝酸铵含有氮原子数为2NA
B.1 L 1 mol·L-1的盐酸溶液中,所含氯化氢分子数为NA
C.标准状况下,11.2 L四氯化碳所含分子数为0.5 NA
D.在铜与硫的反应中,1 mol铜失去的电子数为2NA
16.(6分)将一定量的CO2气体通入500 mL某NaOH溶液,充分反应后,将溶液在低温下蒸发,得到不含结晶水的白色固体A。取三份质量不同的该白色固体A分别与50 mL相同浓度的盐酸反应,得到气体的体积(标准状况)与固体A的质量关系如下表所示。
|
组别 |
1 |
2 |
3 |
|
盐酸的体积(mL) |
50 |
50 |
50 |
|
固体A的质量(g) |
3.80 |
6.20 |
7.20 |
|
气体体积(mL) |
896 |
1344 |
1344 |
(1)上表中第 组数据表明加入的50 mL盐酸反应后有剩余,其理由是 。
(2)请通过计算、讨论、判断固体A是什么物质,其成分的质量百分含量为多少?
15.(8分)使一定量的磷化氢和氢气的混合气体,依次通过两支加热的硬质玻璃管,第一支玻璃管中装有铜屑,第二支玻璃管中装有氧化铜,第一支试管中由于发生如下反应:2PH3+Cu Cu3P2(s)+3H2,玻璃管中物质的质量增加4.96 g,第二支玻璃管中物质的质量减少了5.76 g。(1)计算原混合气体中磷化氢和氢气的体积比。
Cu3P2(s)+3H2,玻璃管中物质的质量增加4.96 g,第二支玻璃管中物质的质量减少了5.76 g。(1)计算原混合气体中磷化氢和氢气的体积比。
(2)在标准状况下,原混合气体的密度是多少?
14.(6分)计算以下两小题时,除必须应用所有给出的数据外,还缺少一个数据,指出该数据的名称,并分别以a和b表示,列出计算式。
(1)在温度为t℃和压强为p Pa时,19.5 g A与11 g B恰好完全反应,生成固体C和3.00 L气体D,计算生成C的质量(m)。
缺少的数据是 ,计算式为m= 。
(2)0.48 g金属镁与10 mL盐酸反应,计算生成的H2在标准状况下的体积[V(H2)]。
缺少的数据是 ,计算式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com