
题目列表(包括答案和解析)
9.将铝粉放入烧碱溶液中,若反应过程中有1.5 mol电子发生转移,则参加反应的水为
A.9 g B.18 g
C.0.5 mol D.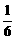 mol
mol
8.m g钠、铝混合物,放入n g水中,反应停止后,仍有不溶物a g,则溶液中溶质为
A.NaOH
B.NaAlO2
C.NaOH和NaAlO2
D.无法确定
7.将AlCl3溶液和NaOH溶液等体积混合得到的沉淀物和溶液中所含铝元素的质量相等,则原AlCl3溶液和NaOH溶液物质的量浓度之比可能是
A.2∶3 B.1∶3
C.1∶4 D.2∶7
6.在氯化镁和硫酸镁的混合液中,若Mg2+与Cl-的物质的量浓度之比为4∶3时,下列判断正确的是
A.溶液中Mg2+与SO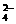 的物质的量浓度相等
的物质的量浓度相等
B.溶液中Mg2+与SO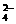 物质的量浓度之比为5∶8
物质的量浓度之比为5∶8
C.溶液中Mg2+与SO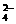 物质的量浓度之比为8∶5
物质的量浓度之比为8∶5
D.溶液中氯化镁和硫酸镁物质的量相等
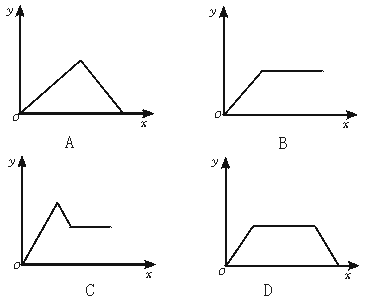
5.在硝酸铝和硝酸镁的混合溶液中,逐滴加入稀氢氧化钠溶液,直至过量。下列表示氢氧化钠加入量(x)与溶液中沉淀物的量(y)的关系示意图中正确的是
4.下列气体逐渐通入NaAlO2溶液中,开始时产生沉淀,继续通入气体时沉淀又溶解,该气体是
A.NO2 B.NO
C.CO2 D.H2S
3.人的纯净的胃液是一种强酸性液体,pH在0.9-1.5左右,氢氧化铝是一种治疗胃液过多的胃药的主要成分,目前这种胃药已不常用,原因主要是
A.长期摄入铝元素不利于人体健康
B.它不能中和胃液
C.它不易溶于胃液
D.它的疗效太差
2.将某物质的量的镁和铝相混合,取等质量的该混合物四份,分别加到足量的下列溶液中,充分反应后,放出氢气最多的是
A.3 mol·L-1 HCl
B.4 mol·L-1的HNO3
C.8 mol·L-1 NaOH
D.18 mol·L-1 H2SO4
1.(2001年春季高考题)将一定质量的Mg、Zn、Al混合物与足量稀H2SO4反应,生成H2 2.8 L(标准状况),原混合物中的质量可能是
A.2 g B.14 g
C.8 g D.10 g
16.(12分)(2001年全国高考卷)已知Fe2O3在高炉中有下列反应:
Fe2O3+CO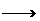 2FeO+CO2
2FeO+CO2
反应形成的固体混合物(含Fe2O3和FeO)中,元素铁和氧的质量比用m(Fe)∶m(O)表示。
(1)上述固体混合物中,m(Fe)∶m(O)不可能是 (选填a、b、c多选扣1分)。
a.21∶9 b.21∶7.5 c.21∶6
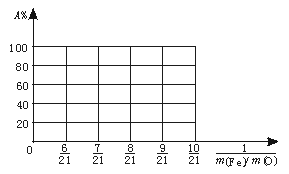
(2)若m(Fe)∶m(O)=21∶8,计算Fe2O3被CO还原的百分率。
(3)设Fe2O3被CO还原的百分率为A%,则A%和混合物中m(Fe)∶m(O)的关系式为[用含m(Fe)、m(O)的代数式表示]A%= 。
请在下图中画出A%和m(Fe)∶m(O)关系的图形。
(4)如果Fe2O3和CO的反应分两步进行:
3Fe2O3+CO 2Fe3O4+CO2 Fe3O4+CO
2Fe3O4+CO2 Fe3O4+CO 3FeO+CO2
3FeO+CO2
试分析反应形成的固体混合物可能的组成及相应的m(Fe)∶m(O)[令m(Fe)∶
m(O)=21∶a,写出a的取值范围]。将结果填入下表。
|
混合物组成(用化学式表示) |
a的取值范围 |
|
|
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com