
题目列表(包括答案和解析)
4.用铁酸钠(Na2FeO4)对来自河湖的淡水消毒是城市饮用水处理新技术,下列对Na2FeO4用于饮用水消毒处理的分析正确的是
A.Na2FeO4在溶液中显强碱性,能消毒杀菌
B.在Na2FeO4中Fe为+6价,具有强氧化性,能消毒杀菌
C.Na2FeO4的还原产物Fe3+易水解为Fe(OH)3胶体,可使水中悬浮物凝聚沉降
D.Na2FeO4的还原产物是Fe2+,易水解为Fe(OH)2,可使水中悬浮物凝聚沉降
3.下列说法或做法正确的是
A.医生可用FeCl3溶液做止血剂,原理是电解质使胶体凝聚
B.在蛋白质溶液中加入饱和(NH4)2SO4溶液,可使蛋白质变性
C.工业上用98%的硫酸与纤维素混合后水浴加热来直接制取葡萄糖
D.用碱式滴定管盛装KMnO4溶液
2.(2002年上海高考题)将饱和FeCl3溶液分别滴入下述液体中,能形成胶体的是
A.冷水 B.沸水
C.NaOH浓溶液 D.NaCl浓溶液
1.(2001年上海高考题)氯化铁溶液与氢氧化铁胶体具有的共同性质是
A.分散质颗粒直径都在1 nm-100 nm之间
B.能透过半透膜
C.加热蒸干、灼烧后都有氧化铁生成
D.呈红褐色
15.(8分)在标准状况下进行甲、乙、丙三组实验,三组各取30 mL同浓度的盐酸溶液,加入同一种镁铝合金粉末,产生气体,有关数据列表如下:
|
实验序号 |
甲 |
乙 |
丙 |
|
合金质量(mg) |
255 |
385 |
459 |
|
生成气体体积(mL) |
280 |
336 |
336 |
(1)甲组实验中,盐酸 (填“过量”“适量”或“不足量”),理由是 。乙组实验中,盐酸 (填“过量”“适量”或“不足量”),理由是 。要算出盐酸的物质的量浓度,题中可作计算依据的数据是 ,求得的盐酸的物质的量浓度为 。
(2)求合金中Mg、Al的物质的量之比,题中可作计算依据的数据是 ,求得的Mg、Al的物质的量之比为 。
(3)在丙组实验之后,向容器中加入1 mol·L-1的氢氧化钠溶液,能使合金中的铝恰好溶解,不形成含铝的沉淀,并使Mg2+刚好沉淀完全,再过滤出不溶固体,求滤液中各溶质的物质的量和所加入氢氧化钠溶液的体积(写计算过程)。
14.(8分)有铝粉和四氧化三铁组成的铝热剂,在隔绝空气的条件下灼烧,使之充分反应。将所得混合物研细并分成两等份,分别投入过量的烧碱溶液和盐酸中。充分反应后,前者消耗m mol NaOH,放出气体0.336 L;后者消耗n mol HCl,放出气体V L。若将等质量的这种铝热剂中的铝粉与足量的稀硫酸作用,可得3.36 L气体(气体体积均在标准状况下测定。)求:
(1)该铝热剂的质量分数。
(2)m、n、V的值。
13.(10分)镁是一种很活泼的金属,常用作脱硫剂、脱氧剂。在电子工业中利用镁制取硅的反应为:
2Mg+SiO2 2MgO+Si
2MgO+Si
同时有副反应发生:2Mg+Si Mg2Si
Mg2Si
Mg2Si遇盐酸迅速反应生成SiH4(硅烷)。
SiH4在常温下是一种不稳定、易分解的气体。

(1)图(甲)是进行Mg与SiO2反应的实验装置。
Ⅰ.由于O2的存在对该实验有较大影响,实验中应通入X气体作为保护气。X气体应选用①CO2、②N2、③H2中的 。
Ⅱ.实验开始时,必须先通入X的气体,再接通电源加热反应物,其理由是 ;当反应引发后,切断电源,反应能继续进行,其原因是 。
Ⅲ.反应结束时,待冷却至常温后,关闭K,从分液漏斗处加入稀盐酸,可观察到导管口a处有闪亮的火星。据此现象可推知 在空气中能自燃。
(2)图(乙)所示装置进行的实验如下:先关闭K,使A中反应进行;加热玻璃管C,可观察到C管中发出耀眼白光,产生白烟,管壁上附着有淡黄色物质。实验完成后,将C管中固体全部加入盐酸中,有臭鸡蛋气味的气体生成。
Ⅰ.C中的Mg应放在不锈钢垫片上而不能直接接触管壁,这是因为 。
Ⅱ.停止实验时,先打开K,再停止滴加浓硫酸并熄灭酒精灯。橡胶气胆B在实验中的作用是 。
Ⅲ.C中全部反应产物有 、 、 。(填化学式)
12.(12分)今用铝、稀硫酸和氢氧化钠溶液为原料,在实验室制备一定量的氢氧化铝。可分别采用如下化学方程式所表示的两种方法:
①2Al+3H2SO4===Al2(SO4)3+3H2↑
Al2(SO4)3+6NaOH===2Al(OH)3↓+3Na2SO4
②2Al+2NaOH+2H2O===2NaAlO2+3H2↑
2NaAlO2+H2SO4+2H2O===2Al(OH)3↓+Na2SO4
(1)上述哪一种方法比较节约试剂?[提示:试从每生产2 mol Al(OH)3所耗费的试剂用量予以说明]
(2)原料相同,请设计一种更为节约试剂的方法(以方程式表示,并说明其可以最节约试剂的根据)。
11.(12分)在50 mL b mol·L-1 AlCl3溶液中加入50 mL a mol·L-1 NaOH溶液。
(1)当a≤3b时,生成Al(OH)3沉淀的物质的量为 。
(2)当a、b满足 条件时,先有沉淀,后又有部分沉淀溶解,此时Al(OH)3的质量为 g。
10.将物质X逐渐加入Y溶液中,生成沉淀物质的量n2与所加X的物质的量n1的关系如图所示。符合图示情况的是
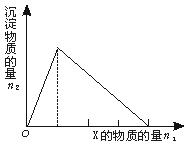
|
|
A |
B |
C |
D |
|
X |
NaOH |
AlCl3 |
HCl |
NaAlO2 |
|
Y |
AlCl3 |
NaOH |
NaAlO2 |
HCl |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com