
题目列表(包括答案和解析)
3.铁棒与石墨棒用导线连接后浸入0.01 mol·L-1的食盐溶液中,可能出现的现象是
A.铁棒附近产生OH- B.铁棒被腐蚀
C.石墨棒上放出Cl2 D.石墨棒上放出O2
2.(2000年上海高考题)随着人们生活质量的不断提高,废电池必须进行集中处理的问题被提到议事日程,其首要原因是
A.利用电池外壳的金属材料
B.防止电池中汞、镉和铅等重金属离子污染土壤和水源
C.不使电池中渗出的电解液腐蚀其他物品
D.回收其中的石墨电极
1.(2003年春季高考理综题)家用炒菜铁锅用水清洗放置后,出现红棕色的锈斑,在此变化过程中不发生的化学反应是
A.4Fe(OH)2+2H2O+O2===4Fe(OH)3↓
B.2Fe+2H2O+O2===2Fe(OH)2↓
C.2H2O+O2+4e-===4OH-
D.Fe-3e-===Fe3+
6.00 A,电解时间t=10.00 h。电解结束温度重新调至T,分离析出KOH·2H2O固体后,测得剩余溶液的总质量为164.8 g。已知不同温度下每100 g饱和溶液中无水氢氧化钾的质量如下表:
|
温度/℃ |
0 |
10 |
20 |
30 |
|
KOH/g |
49.2 |
50.8 |
52.8 |
55.8 |
通过计算先确定温度T的区间,然后求出T(最后计算结果只要求两位有效数字)。
注:法拉第常数F=9.65×104 C·mol-1 A-安培 h-小时 相对原子质量:H:1.01 O:16.0 K:39.1
14.(11分)100.0 g无水氢氧化钾溶于100.0 g水。在T温度下电解该溶液,电流强度I=
13.(12分)碘缺乏症遍及全球,多发生于山区,南美的安第斯山区、欧洲的阿尔卑斯山区和亚洲的喜马拉雅山区是高发病地区。我国云南、河南等十余省的山区发病率也较高,据估计我国患者大约有1000万人左右。为控制该病的发生,较为有效的方法是食用含碘食盐。我国政府以国家标准的方式规定在食盐中添加碘酸钾(KIO3)。据此回答下列问题:
(1)碘是合成下列哪种激素的主要原料之一
A.胰岛素 B.甲状腺激素
C.生长激素 D.雄性激素
(2)长期生活在缺碘山区,又得不到碘盐供应,易患
A.甲状腺亢进 B.佝偻病
C.地方性甲状腺肿 D.糖尿病
(3)可用盐酸酸化的碘化钾和淀粉检验食盐中的碘酸钾。反应的化学方程式为 ,氧化产物与还原产物的物质的量之比为 ,能观察到的明显现象是 。
(4)已知KIO3可用电解方法制得,原理是:以石墨为阳极,以不锈钢为阴极,在一定电流强度和温度下电解KI溶液。总反应化学方程式为:
KI+3H2O KIO3+3H2↑,则两极反应式分别为:阳极
,阴极
。
KIO3+3H2↑,则两极反应式分别为:阳极
,阴极
。
(5)在某温度下,若以12 A的电流强度电解KI溶液达10 min,理论上可得标准状况下的氢气 L。
12.(12分)氯碱厂电解饱和食盐水制取NaOH的工艺流程如下图:
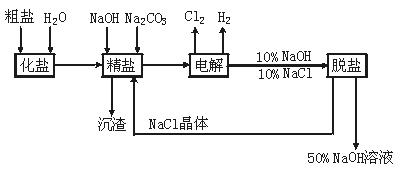
完成下列填空:
(1)在电解过程中,与电源正极相连的电极上的电极反应式为 。与电源负极相连的电极附近溶液pH (填“不变”“升高”或“下降”)。
(2)工业食盐含Ca2+、Mg2+等杂质。精制过程发生反应的离子方程式为 、 。
(3)如果粗盐中SO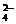 含量较高,必须添加钡试剂除去SO
含量较高,必须添加钡试剂除去SO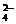 ,该钡试剂可以是 (选填“A”“B”“C”,多选扣分)。
,该钡试剂可以是 (选填“A”“B”“C”,多选扣分)。
A.Ba(OH)2 B.Ba(NO3)2 C.BaCl2
(4)为有效除去Ca2+、Mg2+、SO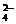 ,加入试剂的合理顺序为
(选填“A”“B”“C”,多选扣分)
,加入试剂的合理顺序为
(选填“A”“B”“C”,多选扣分)
A.先加NaOH,后加Na2CO3,再加钡试剂
B.先加NaOH,后加钡试剂,再加Na2CO3
C.先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过 、冷却、 (填写操作名称)除去NaCl。
(6)在隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜电解冷的食盐水时,Cl2与NaOH充分接触,产物仅是NaClO和H2,无隔膜电解食盐水的总的化学方程式为 。
11.(8分)蓄电池使用日久后,正负极标志模糊,现根据下列两种条件,如何判断正负极:
(1)氯化铜溶液,两根带铜导线的碳棒 。
(2)硫酸铜溶液,两根铜导线 。
10.(12分)由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀,应用下图电解实验可以制得白色纯净的Fe(OH)2沉淀。两电极材料分别为石墨和铁。
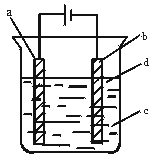
(1)a电极材料应为 ,电极反应式为 。
(2)电解液c可以是 。(填编号)
A.纯水 B.NaCl溶液
C.NaOH溶液 D.CuCl2溶液
(3)d为苯,其作用是 ,在加入苯之前对c应作何简单处理 。
(4)为了在较短时间内看到白色沉淀,可采取的措施是(填编号) 。
A.改用稀硫酸做电解液
B.适当增大电源的电压
C.适当减小两电极间距离
D.适当降低电解液的温度
(5)若c中用Na2SO4溶液,当电解一段时间看到白色Fe(OH)2沉淀后,再反接电源电解,除了电极上看到气泡外,混合物中另一明显现象为 。
9.用Pt电极电解CuCl2溶液,当电流强度为a A,通电时间为t min时,阴极质量增加m g,阳极上生成标准状况下纯净气体V L,电极上产生的气体在水中的溶解忽略不计,且以q表示1个电子的电量,M表示铜的相对原子质量,则阿伏加德罗常数可表示为
A.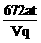 B.
B.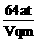
C.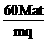 D.不能确定
D.不能确定
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com