
题目列表(包括答案和解析)
13.(12分)下表数据是在某高温下,金属镁和镍分别在氧气中进行氧化反应时,在金属表面生成氧化薄膜的实验记录:
|
反应时间t/h |
1 |
4 |
9 |
16 |
25 |
|
MgO层厚y/nm |
0.05a |
0.20a |
0.45a |
0.80a |
1.25a? |
|
NiO层厚y′/nm |
B |
2b |
3b |
4b |
5b |
注:a和b均为与温度有关的常数。?
请填空回答:
(1)金属高温氧化腐蚀速率可以用金属氧化膜的生长速率来表示,其理由是 。
(2)金属氧化膜的膜厚y跟时间t所呈现的关系是(填“直线”“抛物线”“对数”或“双曲线”):MgO氧化膜厚y属 型,NiO氧化膜厚y′属 型。
(3)Mg与Ni比较,哪一种金属更具有耐腐蚀性 ,其理由是 。
12.(10分)(1)今有反应2H2+O2 2H2O构成了燃料电池,则负极通的应是
,正极通的应是
。电极反应式为:负极
,正极:
。
2H2O构成了燃料电池,则负极通的应是
,正极通的应是
。电极反应式为:负极
,正极:
。
(2)如把KOH改为稀H2SO4做电解质,则电极反应式为:负极 ,正极 。两电极附近溶液的pH各有何变化?
(3)如把H2改为CH4、KOH做导电物质,则电极反应式为:负极 ,正极 。
11.(10分)(2000年全国高考理综卷)熔融盐燃料电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物做电解质,CO为阳极燃气,空气与CO2的混合气为阴极燃气,制得在650℃下工作的燃料电池,完成有关的电池反应式:
阳极反应式:2CO+2CO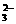
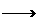 4CO2+4e-
4CO2+4e-
阴极反应式:
总电池反应式:
10.(10分)如右图所示的装置,在盛有水的烧杯中,铁圈和银圈的连接处吊着一根绝缘的细丝,使之平衡。小心地从烧杯中央滴入CuSO4溶液。
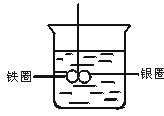
(1)片刻后可观察到的现象是(指悬吊的金属圈) 。
A.铁圈和银圈左右摇摆不定
B.保持平衡状态不变
C.铁圈向下倾斜
D.银圈向下倾斜
(2)产生上述现象的原因是 。
9.将两个铂电极插入KOH溶液中,向两极分别通入CH4和O2,即构成CH4燃料电池。已知通入CH4的一极,其电极反应式是:CH4+10OH--8e-===CO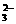 +7H2O;通入O2的另一极,其电极反应是:O2+2H2O+4e-===4OH-,下列叙述不正确的是
+7H2O;通入O2的另一极,其电极反应是:O2+2H2O+4e-===4OH-,下列叙述不正确的是
A.通入CH4的电极为负极
B.正极发生氧化反应
C.燃料电池工作时溶液中的阴离子向负极移动
D.该电池使用一段时间后应补充KOH
8.据报道,美国正在研究的新电池可能取代目前广泛使用的铅蓄电池,它具有容量大等优点,其电池反应为2Zn+O2===2ZnO,原料为锌粒、电解液和空气,则下列叙述正确的是
A.锌为正极,空气进入负极反应
B.负极反应为Zn-2e-===Zn2+
C.正极发生氧化反应
D.电解液肯定不是强酸
7.锂电池是新一代的高能电池,它以质轻、能高而受到普遍重视,目前已经研制成功了多种锂电池。某种锂电池的总反应可表示为:Li+MnO2===LiMnO2。若该电池提供5库仑(C)电量(其他损耗忽略不计),则消耗的正极材料的质量约为(式量Li:7;MnO2:87,电子电量取1.60×10-19C)
A.3.2×103 g B.7×10-4 g
C.4.52×10-3 g D.4.52×10-2 g
6.以下现象与电化腐蚀无关的是
A.黄铜(铜锌合金)制作的铜锣不易产生铜绿
B.生铁比软铁芯(几乎是纯铁)容易生锈
C.铁质器件附有铜质配件,在接触处易生铁锈
D.银制奖牌久置后表面变暗
5.生物体中细胞膜内的葡萄糖,细胞膜外的富氧液体及细胞膜构成微型的生物原电池,下列有关判断正确的是
A.负极发生的电极反应可能是: O2-4e-+2H2O===4OH-
B.正极发生的电极反应可能是: O2-4e-===2O2-
C.负极反应主要是C6H12O6生成CO2或HCO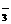
D.正极反应主要是C6H12O6生成CO2或CO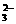
4.某原电池总反应的离子方程式为2Fe3++Fe===3Fe2+,不能实现该反应的原电池组成是
A.正极为铜,负极为铁,电解质溶液为FeCl3溶液
B.正极为碳,负极为铁,电解质溶液为Fe(NO3)3溶液
C.正极为铁,负极为锌,电解质溶液为Fe2(SO4)3溶液
D.正极为银,负极为铁,电解质溶液为CuSO4溶液
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com