
题目列表(包括答案和解析)
8.下列各组离子,能在水溶液里大量共存,并且加入H+呈强酸性时,有沉淀生成的离子组是
A.K+、OH-、S2-、SO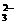
B.Na+、K+、SO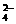 、S2O
、S2O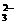
C.Mg2+、Al3+、SO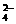 、AlO
、AlO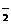
D.Ca2+、Fe2+、Cl-、NO
7.下列各组中两种溶液之间的反应,可以用同一个离子方程式表示的是
A.AgNO3+HCl Ag2SO4+BaCl2
B.HCl+Na2CO3 HCl+NaHCO3
C.H2SO4+Ba(OH)2 Na2SO4+Ba(OH)2
D.KOH+(NH4)2SO4 Ba(OH)2+NH4Cl
6.等体积等物质的量浓度的NaHCO3溶液和Ba(OH)2溶液混合,离子方程式正确的是
A.HCO +OH-===H2O+CO
+OH-===H2O+CO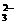
B.2HCO +Ba(OH)2===BaCO3↓+2H2O+CO
+Ba(OH)2===BaCO3↓+2H2O+CO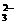
C. HCO +Ba2++OH-===H2O+BaCO3↓
+Ba2++OH-===H2O+BaCO3↓
D.2HCO +Ba2++2OH-===BaCO3↓+2H2O+CO
+Ba2++2OH-===BaCO3↓+2H2O+CO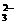
5.xR2++yH++O2===mR3++nH2O的离子方程式中,对m和R3+判断正确的是
A.m=4,R3+是氧化产物
B.m=y,R3+是氧化产物
C.m=2,R3+是还原产物
D.m=y/2,R3+是还原产物
4.(2001年上海高考题)下列离子在溶液中因发生氧化还原反应而不能大量共存的是
A.H3O+、NO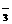 、Fe2+、Na+
、Fe2+、Na+
B.Ag+、NO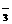 、Cl-、K+
、Cl-、K+
C.K+、Ba2+、OH-、SO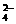
D.Cu2+、NH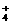 、Br-、OH-
、Br-、OH-
3.(2002年上海高考题)在pH=1的无色溶液中能大量共存的离子组是
A.NH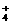 、Mg2+、SO
、Mg2+、SO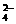 、Cl-
、Cl-
B.Ba2+、K+、OH-、NO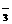
C.Al3+、Cu2+、SO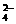 、Cl-
、Cl-
D.Na+、Ca2+、Cl-、AlO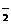
2.(2002年上海高考题)下列离子方程式书写正确的是
A.FeCl2溶液中通入Cl2∶Fe2++Cl2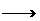 Fe3++2Cl-
Fe3++2Cl-
B.澄清石灰水与少量小苏打溶液混合: Ca2++OH-+HCO
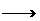 CaCO3↓+H2O
CaCO3↓+H2O
C.FeS固体放入稀硝酸溶液中: FeS+2H+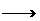 Fe3++H2S↑
Fe3++H2S↑
D.AlCl3溶液中加入过量氨水: Al3++4OH- AlO
AlO +2H2O
+2H2O
1.(2002年全国高考题)下列离子方程式书写正确的是
A.碳酸氢钙溶液中加入过量的氢氧化钠溶液 HCO +OH-===CO
+OH-===CO +H2O
+H2O
B.氯化铁溶液中通入硫化氢气体 2Fe3++S2-===2Fe2++S↓
C.次氯酸钙溶液中通入过量二氧化碳 Ca2++2ClO-+H2O+CO2===CaCO3↓+2HClO
D.氯化亚铁溶液中加入硝酸 3Fe2++4H++NO ===3Fe3++2H2O+NO↑
===3Fe3++2H2O+NO↑
15.(5分)关于“电解氯化铜溶液时的pH变化”问题,化学界有以下两种不同的观点:
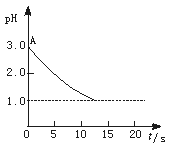
pH与时间关系图
观点一是:“理论派”认为电解氯化铜溶液后溶液的pH升高。
观点二是:“实验派”经过反复、多次、精确的实验测定,证明电解氯化铜溶液时pH的变化如图曲线的关系。
请回答下列问题:
(1)电解前氯化铜溶液的pH处在A点位置的原因是 (用离子方程式说明)。
(2)“理论派”所持观点的理论依据是 。
(3)“实验派”的实验结论是 。他们所述“精确实验”是通过 确定的。
(4)你持何种观点?你所持观点的理由是 (从化学原理加以简述)。
14.(8分)电池在人们的日常生活、工农业生产、教学科研等各个方面具有广泛的应用。电池按不同的划分标准可以划分为不同的种类,应用最广泛的是电化学电池。
(1)电化学电池能够把 能转化为 能。电化学电池的工作原理是 的迁移扩散和电化学反应。下列属于电化学电池的有 。
①蓄电池 ②锌锰电池 ③充电电池 ④一次性电池
(2)电化学电池的组成可以表示为:(-)负极材料‖A‖正极材料(+)。A表示 ,离子在A中的电阻比电子在金属中的电阻 。对于不漏电的电池电子在A中的电阻为 。
(3)1991年Sony公司首次推出商品化的锂离子电池,此后锂离子电池的厂家如雨后春笋般在全世界出现,锂离子电池的品种和数量也在逐年增加。锂离子电池的电压高,单个电池的电压是3.6 V,锂离子电池的正极材料是锂的过渡金属氧化物(例如LiCoO2)混以一定量的导电添加物(例如C)构成的混合导体,负极材料是可插入锂的碳材料。
①锂在元素周期表中位于第 周期,第 主族。
②锂离子电池所用的正负极材料都是不污染环境的无毒无害物质,属于绿色能源。而镉镍在生产过程中污染环境。(作为密封电池无毒无害可以放心使用)镉镍电池的有毒物质是 ,它作为电池的 极。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com