
题目列表(包括答案和解析)
4.室温下用0.1 mol·L-1 NaOH溶液滴定a mL某浓度的HCl溶液,达到终点时消耗NaOH溶液b mL,此时溶液中氢离子的浓度c(H+)/mol·L-1是
A.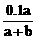 B.
B.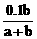
C.1×107 D.1×10-7
3.下图是向100 mL的盐酸中逐渐加入NaOH溶液时,溶液的pH变化图。根据图所得结论正确的是
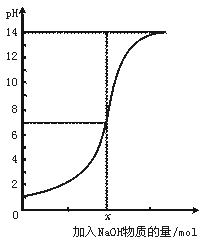
A.原来盐酸的物质的量浓度为0.1 mol·L-1
B.x处为0.1 mol的NaOH溶液
C.原来盐酸的物质的量浓度为1 mol·L-1
D.x处为0.01 mol的NaOH溶液
2.有一支50 mL酸式滴定管,其中盛有溶液,液面恰好在10.0 mL刻度处,把滴定管中的溶液全部流下排出,承接在量筒中,量筒内溶液的体积
A.大于40.0 mL B.为40.0 mL
C.小于40.0 mL D.为10.0 mL
1.(2003年春季高考理综题)以上是几种酸碱指示剂变色的pH范围:①甲基橙3.1-4.4 ②甲基红4.4-6.2 ③酚酞8.2-10,现用0.1000 mol·L-1 NaOH溶液滴定浓度相近的甲酸时,上述指示剂
A.都可以用 B.只能用③
C.可以用①或② D.可以用②或③
16.(1)I2<Br2<KIO3<KBrO3
(2)Br2、I2、KIO3、K2SO4、H2O 3∶3∶4∶6∶6
15.(1)5I-+IO +6H+===3I2+3H2O
+6H+===3I2+3H2O
(2)0.2 mol·L-1
14.(1)a.NH +H2O
+H2O NH3·H2O+H+
NH3·H2O+H+
b.NH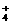 与H+交换,H+进入溶液
与H+交换,H+进入溶液
(2)Fe2++NO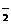 +2H+===Fe3++NO↑+H2O
+2H+===Fe3++NO↑+H2O
(3)3CaCO3+2FeCl3+3H2O===3CaCl2+2Fe(OH)3↓+3CO2↑
(4)Cr2O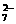 +6Fe2++14H+===2Cr3++6Fe3++7H2O
+6Fe2++14H+===2Cr3++6Fe3++7H2O
13.2H2S+3OH-===HS-+S2-+3H2O
12.(1)2H++SO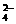 +Ba2++2OH-===BaSO4↓+H2O
+Ba2++2OH-===BaSO4↓+H2O
Ba2++SO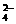 ===BaSO4↓
===BaSO4↓
(2) Ba2++OH-+H++SO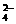 ===BaSO4↓+H2O
===BaSO4↓+H2O
H++OH-===H2O
(2)CO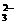 、SO
、SO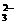 、SO
、SO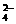
(3)OH-、S2-、CO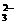 、SO
、SO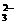
(4)Ag+ Ba2+
11.(1)2MnO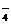 +SO
+SO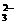 +2OH-===2MnO
+2OH-===2MnO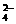 +SO
+SO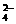 +H2O
+H2O
(2)12Fe2++3O2+6H2O===8Fe3++4Fe(OH)3↓
(3)反应中,离子反应总是向有利于生成溶解度更小的物质的方向进行,3Ca2++6H2PO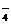 +9OH-===Ca3(PO4)2↓+PO
+9OH-===Ca3(PO4)2↓+PO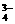 +3HPO
+3HPO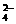 +9H2O
+9H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com