
题目列表(包括答案和解析)
10、(广东卷19).(11分)
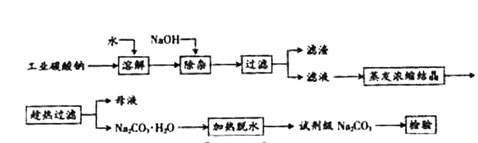 碳酸钠是造纸、玻璃、纺织、制革等行业的重要原料。工业碳酸钠(钝度约98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO
碳酸钠是造纸、玻璃、纺织、制革等行业的重要原料。工业碳酸钠(钝度约98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO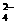 等杂质,提纯工艺路线如下:
等杂质,提纯工艺路线如下:
已知碳酸钠的溶解度(S)随温度变化的曲线如下图所示:
回答下列问题:
(1)滤渣的主要成分为 。
(2)“趁热过滤”的原因是 。
(3)若在实验室进行“趁热过滤”,可采取的措施是 (写出1种)。
(4)若“母液”循环使用,可能出现的问题及其原因是 。
(5)已知:Na2CO3·10H2O(s)=Na2CO3(s)+10H2O(g) ΔH1=+532.36 kJ·mol-1
Na2CO3·10H2O(s)=Na2CO3·H2O(s)+9H2O(g) ΔH1=+473.63 kJ·mol-
写出Na2CO3·H2O脱水反应的热化学方程式 。
9、(四川卷 26)(14分)
某固体混合物可能含有MgCO3、Al2(SO4)3、Na2SO4、Ba(NO3)2、AgNO3和CuSO4。将该混合物进行如下实验,根据所给实验现象完成表格(对于能确定的物质在相应位置写化学式,暂不能确定的物质在相应位置填“无”):
(1) 将少许混合物放入水中得到无色溶液和白色沉淀。
|
肯定存在的物质 |
肯定不存在的物质 |
理由 |
|
|
|
|
(2)取溶液进行焰色反应,火焰呈黄色;
|
肯定存在的物质 |
肯定不存在的物质 |
理由 |
|
|
|
|
(3)取白色沉淀加入稀盐酸,沉淀完全溶解并放出气体。
|
肯定存在的物质 |
肯定不存在的物质 |
理由 |
|
|
|
|
(4)通过上述实验仍无法确定的物质是______________。
9(14分)
(l)
|
无 |
CuSO4 |
溶液无色,而CuSO4溶液为蓝色 |
(2)
|
Na2SO4 |
无 |
钠的焰色反应呈黄色 |
(3)
|
MgCO3 |
Ba(NO3)2 AgNO3 |
MgCO3沉淀溶于盐酸,有气体放出;如有Ba(NO3)2,生成的BaSO4沉淀不溶于盐酸;如有AgNO3,生成的沉淀在盐酸中不消失。 |
(4)Al2(SO4)3
8、(宁夏卷26)(14分)
某厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子。有人设计了图中的工艺流程,利用常用的酸、碱和工业生产中的废铁屑,从废水中回收金,并生产一定量的铁红和氧化铜。
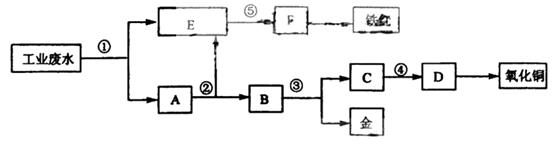
填写下面空白。
(1)图中标号处需加入的相应物质分别是① 、② 、③ 、④ 、⑤ ;
(2)写出①处发生反应的离子方程式 ;写出③处发生反应的化学方程式 ;
(3)铁红的化学式为 ;分别写出铁红和氧化铜在工业上的一种主要用途:铁红 ;氧化铜 。
8(14分)
(1)①铁屑 ②稀硫酸 ③稀硝酸 ④氢氧化钠 ⑤氢氧化钠
(2)Fe+2H+=Fe2++H2↑ 2Fe3++Fe=3Fe2+
Cu2++Fe=Cu+Fe2+ 2Au3++3Fe=2Au+3Fe2+
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(3)Fe2O3 用作红色涂料 用作制造铜盐的原料
7.(14分)
(1)NaHSO4, MgSO4,A1C13, NH4NO3, Ba(OH)2
(2)Ba2++2OH-+2H++SO42-==BaSO4↓+2H2O
(3)2NH4NO3 2N2↑+O2↑+4H2O
7.(14分)现有几种离子
|
阳离子 |
Na+、Mg2+、A13+、Ba2+、NH4+ |
|
阴离子 |
OH-、C1-、NO3-、SO42-、HSO4- |
A、B、C、D、E是由它们组成的五种可溶于水的固体(每种离子只能用一次),分别取它们进行实验,结果如下:
①将D与E的溶液混合加热,产生刺激性气味的气体;
②将B与E的溶液混合,产生白色沉淀,向该沉淀中加入足量的稀硝酸,沉淀部分溶解;
③向一定量的E溶液中逐滴加入C溶液,先无明显现象,后来产生白色沉淀,且该沉淀可溶于A溶液;
④D固体在一定温度下可以分解为水和另外两种均为空气主要成分的气体单质。
根据上述信息回答下列问题:
(1)根据以上条件推断并写出下列物质的化学式:
A ;
B ;
C ;
D ;
E ;
(2)写出A溶液与E溶液恰好完全反应至溶液呈中性的离子方程式:
。
(3)写出D固体分解的化学方程式 。
6. (1)①20%的H2O2(1分) 将废液中的Fe2+氧化为Fe3+,同时避免引入新的杂质(1分)
②(3分)ZnO [或Zn(OH)2或ZnCO3](1分) 调节溶液的pH至3.7~5.7(1分),使Fe3+全部转化为Fe(OH)3沉淀,同时避免Zn2+损失和引入其它杂质(1分)[若只答调节pH不给分]
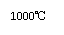 ③重结晶 ④为了冲洗掉晶体表面的杂质离子,同时防止晶体溶解影响产率
③重结晶 ④为了冲洗掉晶体表面的杂质离子,同时防止晶体溶解影响产率
⑤ ZnSO4·7H2O====== ZnO+SO3↑+7H2O↑
6.(10分)用粗锌(含少量Fe等杂质)与稀硫酸反应制氢气,其废液中含有大量的硫酸锌。同学们用制氢气的废液来制取皓矾(ZnSO4·7H2O),并探究其性质。 实验流程如下图所示:
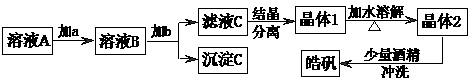
已知:氢氧化物沉淀的pH范围见右表。请回答下列问题:
|
氢氧化物 |
Fe(OH)3 |
Fe(OH)2 |
Zn(OH)2 |
|
开始沉淀pH |
2.7 |
7.6 |
5.7 |
|
完全沉淀pH |
3.7 |
9.6 |
8.0 |
① 加入的试剂a,供选择使用的有:氨水、NaClO溶液、20%的H2O2、浓硫酸、浓硝酸等,应选用 ,其理由是 。
② 加入的试剂b,供选择使用的有: Zn粉、ZnO、Zn(OH)2、ZnCO3、ZnSO4等,应选用 ,其理由是 。
③从晶体l→晶体2,该过程的名称是 。
④在得到皓矾时,向晶体中加入少量酒精洗涤而不用水的原因是 。
⑤称取28.7g ZnSO4·7H2O研细后置于坩埚中小心加热,其固体质量与温度的对应数据见右表。则1000℃时皓矾的反应方程式为 。
|
温度(℃) |
60 |
240 |
930 |
1000 |
|
残留固体质量(g) |
19.7 |
16.1 |
8.1 |
8.1 |
5.(1)b;
(2)将亚铁离子氧化为铁离子;
(3)除去过量的硫酸;不引入新的杂质;
(4)Fe3++3H2O=Fe(OH)3↓+3H+;(条件:加热)
(5)抑制Cu2+的水解;产生污染环境的二氧化硫,硫酸利用率低;加热,并在稀硫酸中通入氧气。(注:本题为发散性试题,如有其它合理答案,酌情给分)
5. 胆矾是一种常见的化合物,工业上它也是一种制取其它含铜化合物的原料。现有废铜(主要杂质为Fe)来制备胆矾。有人设计了如下流程:
胆矾是一种常见的化合物,工业上它也是一种制取其它含铜化合物的原料。现有废铜(主要杂质为Fe)来制备胆矾。有人设计了如下流程:
pH值控制可参考下列数据
|
物
质 |
开始沉淀时的pH值 |
完全沉淀时的pH值 |
|
氢氧化铁 |
2.7 |
3.7 |
|
氢氧化亚铁 |
7.6 |
9.6 |
|
氢氧化铜 |
5.2 |
6.4 |
请根据上述流程回答下列问题:
(1)A物质可选用_____(填字母)。a.稀H2SO4 b.浓H2SO4/ D c.浓FeCl3溶液 d.浓HNO3
(2)I中加H2O2的目的_____________________________________________。
(3)II中加Cu2(OH)2CO3的目的是___________________________________________;
其优点是____________________________________________________________。
(4)III加热煮沸时发生的化学反应的离子方程式为________________________。
(5)V中加H2SO4调节pH=1是为了____________________________________________。
某工程师认为上述流程中所加的A物质并不理想,需作改进,其理由是__________。
若你是该工程师,将对所加的A物质作何改进?请提出建议___________________。
4、(8分)某钠盐溶液可能含有阴离子NO3-,CO32-,SO32-,SO42-,AlO2-,Br-,I-,为鉴定这些离子,分别取少量溶液进行以下实验:
①测得混合液呈碱性;
②加过量稀盐酸后,生成无色无味气体,并得到溶液;
③加NH4Cl溶液有白色沉淀生成;
④加CCl4,滴加少量氯水,振荡后,CCl4层未变色;
⑤加BaCl2溶液产生白色沉淀,分离,在沉淀中加人足量盐酸,沉淀不能完全溶解;
(1)分析上述5个实验,该溶液中肯定存在的阴离子有 CO32-,SO42-,AlO2- ,
不能确定存在的阴离子有 NO3- 。
(2)用离子方程式表示下列实验中涉及到的化学反应

 实验① CO32- + H2O HCO3-
+ OH- ;AlO2-
+ 2H2O
Al(OH)3 + OH- ;
实验① CO32- + H2O HCO3-
+ OH- ;AlO2-
+ 2H2O
Al(OH)3 + OH- ;
实验③ AlO2- + NH4+ + 2H2O == Al(OH)3 ↓+ NH3·H2O 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com