
题目列表(包括答案和解析)
17.(6分)某无色溶液,由Na+、Ag+、Ba2+、Al3+、AlO2-、MnO4-、CO32-、SO42-中的若干组成,取一定溶液进行如下实验:
(1)取适量溶液,加入过量盐酸,有气体生成,并得到溶液A
(2)在所得溶液A中加入过量碳酸氢铵溶液得到溶液B,同时有气体生成,并析出白色沉淀甲
(3)在所得溶液B中加入过量Ba(OH)2溶液,也有气体生成,并析出白色沉淀乙。
根据上述实验回答下列问题:
①溶液中一定不存在的离子是_____________________________________;
②一定存在的离子是_____________________________________________;
③判断沉淀乙成分的方法是_______________________________________。
16.(l)
(2)
|
Na2SO4 |
无 |
钠的焰色反应呈黄色 |
(3)
|
MgCO3 |
Ba(NO3)2 AgNO3 |
MgCO3沉淀溶于盐酸,有气体放出;如有Ba(NO3)2,生成的BaSO4沉淀不溶于盐酸;如有AgNO3,生成的沉淀在盐酸中不消失。 |
(4)Al2(SO4)3
16.(共14分)某固体混合物可能含有MgCO3、Al2(SO4)3、Na2SO4、Ba(NO3)2、AgNO3和CuSO4。将该混合物进行如下实验,根据所给实验现象完成表格(对于能确定的物质在相应位置写化学式,暂不能确定的物质在相应位置填“无”):
(1)将少许混合物放入水中得到无色溶液和白色沉淀。
|
肯定存在的物质 |
肯定不存在的物质 |
理由 |
|
|
|
|
(2)取溶液进行焰色反应,火焰呈黄色;
|
肯定存在的物质 |
肯定不存在的物质 |
理由 |
|
|
|
|
(3)取白色沉淀加入稀盐酸,沉淀完全溶解并放出气体。
|
肯定存在的物质 |
肯定不存在的物质 |
理由 |
|
|
|
|
(4)通过上述实验仍无法确定的物质是______________。
|
无 |
CuSO4 |
溶液无色,而CuSO4溶液为蓝色 |
15.(1)(1)甲: Al2(SO4)3 ,乙:K2CO3 ,丙:AgNO3 ,丁:BaCl2,戊:NH4Br
(2)2Al3++3CO32-+3H2O==2Al(OH)3↓+3CO2↑
15.甲、乙、丙、丁和戊五种溶液,分别由NH4+、K+、Al3+、Ag+、Ba2+和Cl-、Br-、NO3-、SO42-、CO32-中的一种组成(离子不重复出现)。其中甲、丙、戊三种溶液呈酸性,乙溶液呈碱性,甲和乙反应可生成白色沉淀和气体,丁可分别与甲、乙、丙反应生成白色沉淀。
(1)根据上述事实推断上述溶液中溶质的化学式:
甲 ,乙 ,丙 ,丁 ,戊 。
(2)写出甲和乙反应的离子方程式 。
14.(11分)A、B、C、D、E五种可溶性化合物,分别由阳离子Fe3+、 Ba2+、Al3+、Na+、Ag+和阴离子NO3-、OH-、SO42-、Cl-、CO32-中的各一种组成(离子不重复)。现做如下实验:
① A和E的溶液显碱性,0.1mol/L A溶液的pH小于13;
② 在B的溶液中逐滴加入氨水有白色沉淀生成,继续加氨水至过量,沉淀消失;
③ 在C的溶液中加入铁粉,溶液的质量增加;
④ 在D的溶液中加入过量的Ba(OH)2溶液,没有沉淀。
(1)根据以上事实推断A-E的化学式:
A Na2Co3 、B AgNO3 、C Fe2(SO4)3 、D、AlCl3 、E、Ba(OH)2
(2)写出②、③、④的离子方程式:
② Ag++2NH3.H2O=[Ag(NH3)2]++2H2O
③Fe+2Fe3+=3Fe2+
④ Al3++4OH-=AlO2-+2H2O
13、(共8分)
⑴、氯化钡溶液或硝酸钡溶液;硝酸银溶液;硝酸溶液(写化学式不得分,每空1分,3分)
⑵、测定溶液的pH(或加入HNO3后不再产生气泡)(1分)
⑶、除去溶液中过量的Ba2+、Ag+(漏1个离子扣1分,2分)
⑷、蒸发、冷却结晶(漏1个步骤扣1分,2分)
13.(8分)现有含NaCl、Na2SO4、NaNO3的混合溶液,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-、NO3-的相互分离。相应的实验过程可用下列流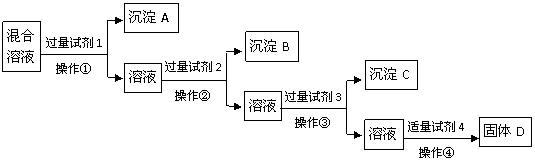 程图表示:
程图表示:
(1)写出上述实验过程中所用试剂的名称:
试剂1___________试剂2_____________试剂4________________
(2)恰当地控制试剂4的加入量的方法是_________________________________
(3)加入过量试剂3的目的是_______________________________
(4)在加入试剂4后,获得固体D的实验操作④是_______________(填操作名称)
12.(11分)A、Na2CO3 B、AgNO3 C、Fe2(SO4)3 D、AlCl3 E、Ba(OH)2(各1分)
Ag+ +2NH3.H2O=[Ag(NH3)2]++2H2O;Fe+2Fe3+= 3Fe2+;Al3++4OH-=AlO2-+2H2O(各2分)
12.(11分)A、B、C、D、E五种可溶性化合物,分别由阳离子Fe3+、 Ba2+、Al3+、Na+、Ag+和阴离子NO3-、OH-、SO42-、Cl-、CO32-中的各一种组成(离子不重复)。现做如下实验:
①A和E的溶液显碱性,0.1mol/L A溶液的pH小于13;
②在B的溶液中逐滴加入氨水有白色沉淀生成,继续加氨水至过量,沉淀消失;
③在C的溶液中加入铁粉,溶液的质量增加;
④在D的溶液中加入过量的Ba(OH)2溶液,没有沉淀。
(1)根据以上事实推断A-E的化学式:
A 、B 、C 、D 、E
(2)写出②、③、④的离子方程式:
②
③
④
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com