
题目列表(包括答案和解析)
4.(10分)在800℃密闭容器中进行反应:
 CO(g)+H2O(g) CO2(g)+H2(g),若CO的起始浓度为1.0×10-2mol·L-1,水蒸气的起始浓度为3.0×10-2mol·L-1,达到平衡后,实验测得CO2浓度为
CO(g)+H2O(g) CO2(g)+H2(g),若CO的起始浓度为1.0×10-2mol·L-1,水蒸气的起始浓度为3.0×10-2mol·L-1,达到平衡后,实验测得CO2浓度为
3.(9分)(1)H++OH-=H2O(1分) NH4++OH- NH3↑+H2O(1分)
NH3↑+H2O(1分)
(2)0.84(2分) (3)1:4 (2分)
(4)Ⅲ(1分) 5 mol·L-1 (2分)
3.(9分)为测定(NH4)2SO4和NH4HSO4固体混合物的组成,现称取该样品四份,分别加入相同物质的量浓度的NaOH溶液各40.00mL,加热到120℃左右,使氨气全部逸出[(NH4)2SO4和NH4HSO4固体分解的温度均高于200℃],测得有关实验数据如下(标准状况):
|
实验序号 |
样品的质量(g) |
NaOH溶液的体积(mL) |
氨气的体积(L) |
|
Ⅰ |
7.4 |
40.00 |
1.68 |
|
Ⅱ |
14.8 |
40.00 |
3.36 |
|
Ⅲ |
22.2 |
40.00 |
1.12 |
|
Ⅳ |
37.0 |
40.00 |
0.00 |
(1)实验过程中发生的有关反应的离子方程式为
;
(2)由Ⅰ组数据直接推测:标准状况下3.7g样品进行同样实验时,生成氨气的体积为 L;
(3)该混合物中(NH4)2SO4和NH4HSO4的物质的量之比为 ;
(4)欲计算该NaOH溶液的物质的量浓度,应选择第 组数据,由此求得NaOH溶液的物质的量浓度为 。
2.(共8分)(1) NaCl(2分)
(2)Na2SO3:0.06 mol(2分), NaCl:0.02 mol(2分);1.344 L(2分)
2.(8分)白色粉末A由Na2SO3、Na2SO4 和NaCl等物质中的二种或三种混合而成,取一定量A样品,投入100 mL 2.2 mol·L-1 盐酸中,充分反应后过滤,最终得到100 mL含H+ 的物质的量浓度为1 mol·L-1 的滤液。若将此滤液蒸干,只得到8.19g纯净物B。
(1)B的化学式 ;
(2)则所取的A样品中含有的各物质的物质的量分别为 ;该样品与投入的盐酸反应后生成气体的体积为(标准状况) 。
1.(5分)溶液中含有Fe2+:0.5mol/L×0.2L=0.1mol
设Fe2(SO4)3反应消耗铁的物质的量为x,与CuSO4反应消耗铁的物质的量为y
Fe+Fe2(SO4)3=3FeSO4 Fe+CuSO4=FeSO4+Cu
1mol 1mol 3mol 1mol 1mol 1mol 1mol
xmol xmol 3xmol ymol ymol ymol ymol
可得:3x+y=0.1mol 6g-56x+8y=5.2g
解得x=0.02mol y=0.04mol
故得:生成铜质量为0.04mol×64g/mol=2.56g
原溶液中Fe2(SO4)3的物质的量浓度为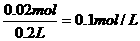
答:(1)反应后生成铜的质量为2.56g。(2)原溶液中Fe2(SO4)3的物质的量浓度为0.1mol/L。
1.(5分)将6g的铁粉加入200mLFe2(SO4)3和CuSO4的混合溶液,充分反应得到200mL、0.5mol/LFeSO4溶液和5.2g固体沉淀物。试计算:
(1)反应后生成铜的质量;
(2)原溶液中Fe2(SO4)3的物质的量浓度。
13.(共5分, 每空1分)
(1)n (2)> > (3)①增大 ②不变
本资料由《七彩教育网》 提供!
12. (四川卷)在密闭容器中进行如下反应:H2(g) +I2(g) 2HI(g),在温度T1和T2时,产物的量与反应时间的关系如下图所示.符合图示的正确判断是D
(四川卷)在密闭容器中进行如下反应:H2(g) +I2(g) 2HI(g),在温度T1和T2时,产物的量与反应时间的关系如下图所示.符合图示的正确判断是D
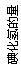
 (2)相同的压强下,充入一定量的A、B后,在不同温度下C的百分
(2)相同的压强下,充入一定量的A、B后,在不同温度下C的百分
含量与时间的关系如图3所示。则T1(填“>”、“<”或“=”)________T2,
该反应的正反应的△H(填“>”、“<”或“=”)_________0。
(3)一定条件下,从正反应开始达到化学平衡过程中,混合气体的平均
相对分子质量随时间的变化如图4所示,测得达到平衡时A、B、C、
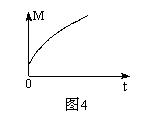 D的物质的量均为1 mol。
D的物质的量均为1 mol。
①若在恒温恒容的条件下,向该平衡体系中再通入A、B、C、D
1 mol,则体系中气体的平均相对分子质量(填“增大”、“减小”、
“不变”或“无法确定”) 。
②若恒温恒压的条件下,向原平衡体系中再通入A、B、C、D各1 mol,
则体系中气体的密度(填“增大”、“减小”、“不变”或“无法确定”) 。
11.在恒压密闭容器M(如图Ⅰ)和恒容密闭容器N(如图Ⅱ)中,分别加入a molA和a molB,起始时两容器体积均为V L,发生如下反应并达到化学平衡状态:
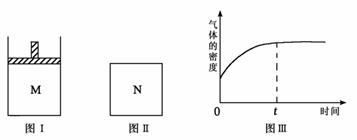
 2A(?)+ B(?) xC(g) ΔH<0
2A(?)+ B(?) xC(g) ΔH<0
平衡时M中A、B、C的物质的量之比为1∶3∶4。下列判断正确的是BC
A.x =4 B.若N中气体的密度如图Ⅲ所示,则A、B有一种是气态
C.若A为气体,B为非气体,则平衡时M、N中C的物质的量相等
D.若A、B均为气体,平衡时M中A的转化率小于N中A的转化率
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com