
题目列表(包括答案和解析)
1.(广东省深圳一模)下列物质中,既含有离子键,又含有共价键的是
A.MgCl2 B.Na2O2 C.Na2O D.Al2O3
20.(8分)苯丙酸诺龙是一种兴奋剂,结构简式为
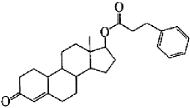
(I)由苯丙酸诺龙的结构推测,它能 (填代号)。
a.使溴的四氯化碳溶液褪色 b.使酸性KMnO4
c.与银氨溶液发生银镜反应 d.与Na2CO3溶液作用生成CO2
苯丙酸诺龙的一种同分异构体A,在一定条件下可发生下列反应:
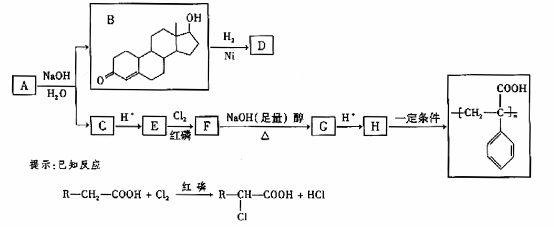
据以上信息回答(2)~(4)题:
(2)B→D的反应类型是 。
(3)C的结构简式为 。
(4)F→G的化学方程式是 。
18.(13分)W、X、Y、Z是原子序数依次增大的同一短同期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物可以反应生盐和水,该反应的离子方程式为 。
(2)W与Y 可形成化合物W2Y,该化合物的电子式为 。
(3)X的硝酸盐水溶液显 性,用离子方程式解释原因 。
(4)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为 。
(5)比较Y、Z气态氢化物的稳定性: > (用分子式表示)。
(6)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是:
> > > 。
(7)Z的最高价氧化物为无色液体,0.25 mol该物质与一定量水混合得到一种稀溶液,并放出QkJ的热量。写出该反应的热化学方程式: 。19.(11分)由Fe2O3、Fe、CuO、C、Al中的几种物质组成的混合粉末,取样品进行下列实验(部分产物略去):
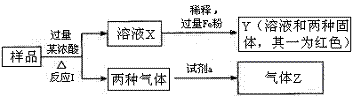
(1)取少量溶液X,加入过量的NaOH溶液,有沉淀生成。取上层清液,通入CO2 ,无明显变化,说明样品中不含有的物质是(填写化学式) 。
(2)Z为一种或两种气体:①若Z只为一种气体,试剂a为饱和NaHCO3溶液,则反应I中能同时生成两种气体的化学方程式是 。
②若Z为两种气体的混合物,试剂a为适量水,则Z中两种气体的化学式是 。
(3)向Y中通入过量氯气,并不断搅拌,充分反应后,溶液中的阳离子是(填写离子符号) 。写出反应的有关离子方程式
17. (11分)铜在自然界存在于多种矿石中,如:
|
矿石名称 |
黄铜矿 |
斑铜矿 |
辉铜矿 |
孔雀石 |
|
主要成分 |
CuFeS2 |
Cu5FeS4 |
Cu2S |
CuCO3·Cu(OH)2 |
请回答下列问题:
(1)上表所列铜化合物中,铜的质量百分含量最高的是 。
(2)工业上以黄铜矿为原料。采用火法溶炼工艺生产铜。该工艺的中间过程会发生
反应:2Cu2O+Cu2S 6Cu+SO2↑,反应的氧化剂是 。
6Cu+SO2↑,反应的氧化剂是 。
(3)SO2尾气直接排放到大气中造成环境污染的后果是 ;处理该尾气可得到有价值的化学品,写出其中1种酸和1种盐的名称 。
(4)黄铜矿熔炼后得到的粗铜含少量Fe、Ag、Au等金属杂质,需进一步采用电解法精制。请简述粗铜电解得到精铜的原理: 。
(5)下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是 (填字母)。
|
选项 |
陈述Ⅰ |
陈述Ⅱ |
判断 |
|
A |
铜绿的主成分是碱式碳酸铜 |
可用稀盐酸除铜器表面的铜绿 |
Ⅰ对;Ⅱ对;有 |
|
B |
铜表易形成致密的氧化膜 |
铜容器可以盛放浓硫酸 |
Ⅰ对;Ⅱ对;有 |
|
C |
铁比铜活泼 |
铆在铜板上的铁钉在潮湿 空气中不易生锈 |
Ⅰ对;Ⅱ对;有 |
|
D |
蓝色硫酸铜晶体受热转化为白色硫酸铜粉末是物理变化 |
硫酸铜溶液可用作游泳池的消毒剂 |
Ⅰ错;Ⅱ对;无 |
16.(12分)在没有氧气存在时,铁与水几乎不反应,但高温下,铁能与水蒸气反应。请设计实验,证明还原铁粉与水蒸气能够发生反应。
(1) 铁粉与水蒸气反应的化学方程式是:
(2) 证明还原铁粉与水蒸气发生了反应的方法是
(3)某同学用如图所示装置进行实验,请帮助该同学完成设计,用下列简图画出未完成的实验装置示意图(铁架台可省略,导气管的形状可根据需要选择)
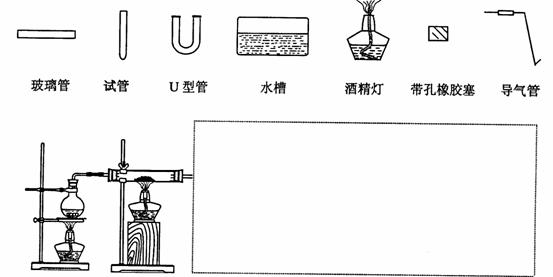
(4)停止反应,待装置冷却后,取出反应过的还原铁粉混合物,加入过量的稀硫酸充分反应,过滤。若混合物中既有Fe2+又有Fe3+,则证明该结论的实验方法是:
(5)经检验上述滤液中不含Fe3+,这不能说明还原铁粉与水蒸气反应所得产物中不含+3价的Fe元素。原因是(结合离子方程式说明)
(6)某同学利用上述滤液制取白色的Fe(OH)2沉淀,向滤液中加入NaOH溶液后,观察到生成的白色沉淀迅速变成灰绿色,最后变成红褐色。
①沉淀由白色→红褐色的化学方程式是: 。
②为了得到白色的Fe(OH)2沉淀,并尽可能长时间保持其白色,可采取的措施有多种,请写出其中的一种。 ______
15.今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、
Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,
沉淀质量为2.33g。根据上述实验,以下推测正确的是
A.K+不一定存在 B.100mL溶液中含0.01mol CO32-
C.Cl-可能存在 D.Ba2+一定不存在,Mg2+可能存在
第Ⅱ卷 (非选择题共55分)
14.向一定量的Fe、FeO和Fe2O3的混合物中加入120mL 4mol/L的稀硝酸,恰好使混合物完全溶解,放出1.344L NO(标准状况),往所得溶液中加入KSCN溶液,无血红色出现。若用足量的氢气在加热下还原相同质量的混合物,能得到铁的物质的量为
A.0.24mol B.0.14mol C.0.16mol D. 0.21mol
13.研究反应物的化学计量数与产物之间的关系时,使用类似数轴的方法可以收到的直观形象的效果。下列表达不正确的是
A.密闭容器中CuO和C高温反应的气体产物: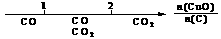
B.Fe在Cl2中的燃烧产物: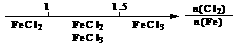
C.AlCl3溶液中滴加NaOH后铝的存在形式: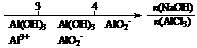
D.氨水与SO2反应后溶液中的铵盐: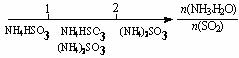
12.在aLAl2(SO4)3和(NH4)2SO4的混合物溶液中加入b molBaCl2,恰好使溶液中的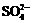 离子完全沉淀;如加入足量强碱并加热可得到c molNH3气,则原溶液中的Al3+离子浓度(mol/L)为
离子完全沉淀;如加入足量强碱并加热可得到c molNH3气,则原溶液中的Al3+离子浓度(mol/L)为
A. B.
B. C.
C.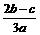 D.
D.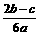
10.下列叙述正确的是( )
A.168O2和188O2互为同位素,性质相似
B.常温下,pH=1的水溶液中Na+、NO3-、HCO3-、Fe3+可以大量共存
C.明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同
D.C(石墨,s)=C(金刚石,s) ΔH>0,所以石墨比金刚石稳定
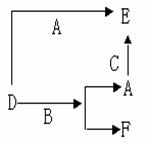 11. A、B、C分别是三种常见的金属或非金属的单质;D、E、F则是常见的三种
11. A、B、C分别是三种常见的金属或非金属的单质;D、E、F则是常见的三种
氧化物,且有如下所示的转化关系。下列说法中错误的是
A.D、E中一定都含有A元素
B.单质B肯定是氧化剂
C.A、B、C中一定有一种是O2
D.若A是非金属,则B一定为金属
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com