
题目列表(包括答案和解析)
27、(共10分)
(1)[Ar]3d5或1s22s22p63s23p63d5 (2分)
(2)N>O>C (2分)
(3)①③⑤(选对1个、2个给1分,选对3个给2分,错选一个倒扣一个,扣完本小题分为止)
(4)H-C≡C-C≡C-C≡C-C≡C-C≡N (2分)
(5)Li (2分)
27.(深圳市二模)(10分)
下表是元素周期表的一部分。表中所列的字母分别代表某一种化学元素。

(1)T3+的核外电子排布式是:
(2)Q、R、M的第一电离能由大到小的顺序是 (用元素符号表示)
(3)下列有关上述元素的说法中,正确的是: (填序号)
①G单质的熔点高于J单质,是因为G单质的金属键较强
②J比X活泼,所以J可以在溶液中置换出X
③将J2M2溶于水,要破坏离子键和共价键
④RE3沸点高于QE4,主要是因为前者相对分子质量较大
⑤一个Q2E4分子中含有五个σ键和一个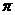 键
键
(4)加拿大天文台在太空发出了EQ9R,已知分子中所有原子均形成8电子或2电子稳定结构,是直线型分子,不存在配位键。写出其结构式:
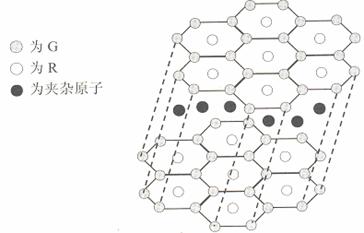
(5)G与R单质直接化合生成一种离子化合物G3R。该晶体具有类似石墨的层状结构。每层中,G原子构成平面六边形,每个六边形的中心有一个R原子。层与层之间还夹杂一定数量的原子。请问这些夹杂的原子应该是 (填G或R的元素符号)
22.(10分,每空2分)
(1)①KI+IBr==KBr+I2 ②C6H6+ICl C6H5I+HCl或写结构简式
C6H5I+HCl或写结构简式
(2)相对分子质量越大,分子间作用力越强(3)介于Br2的沸点和IBr的沸点之间
22、(华附5月月考)(10分)卤素互化物是指不同卤素原子之间以共价键结合形成的化合物,XX’型卤素互化物与卤素单质结构相似、性质相近。试回答下列问题:
 ⑴卤素互化物BrCl能发生下列反应
⑴卤素互化物BrCl能发生下列反应
H2O+BrCl===HBrO+HCl
KBr+BrCl===KCl+Br2
①写出KI与IBr反应的化学方程式______________。
②写出苯与(C6H6)与ICl发生取代反应生成一卤代物的化学方程式____________________________。
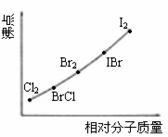
⑵右图是部分卤素单质和XX’型卤素互化物的沸点与其相对分子质量的关系图。它们的沸点随着相对分子质量的增大而升高,其原因是______________。
⑶试推测ICl的沸点所处的最小范围是介于 的沸点和 的沸点之间。
27.(10分)(每小题2分)
⑴①③④ ⑵原子 ⑶②④ ⑷Si3N4 12 ⑸3SiCl4+6H2+2N2 Si3N4+12HCl
Si3N4+12HCl
27.(华附5月月考)(10分)氮化硅是一种高温陶瓷材料,它的硬度大,熔点高,化学性质稳定。工业上曾普遍采用高纯硅与纯氮在1300℃反应获得氮化硅。
⑴根据性质,推测氮化硅陶瓷的用途是
①制汽轮机叶片 ②制有机玻璃 ③制永久性模具 ④制造柴油机
⑵氮化硅晶体属于 晶体(填晶体类型)。
⑶下列物质融化时,所克服的微粒间作用力与氮化硅熔化时所克服的微粒间作用相同的是 。
①单质I2和金刚石 ②晶体硅和二氧化硅 ③冰和干冰 ④金刚石和碳化硅
⑷已知氮化硅晶体结构中,原子间都以单键相连,且N原子和N原子、Si原子和Si原子不直接相连,同时每个原子都满足8电子稳定结构。请写出氮化硅的化学式: ,1 mol 氮化硅晶体中含 mol N-Si键。
⑸现用四氯化硅和氮气在氢气气氛保护下,加强热发生反应,可得较高纯度的氮化硅。反应的化学方程式为: 。
15.(华附5月月考)科学家在高压下成功地将CO2转化为具有类似SiO2结构的晶体,下列关于CO2的原子晶体的说法正确的是
A.CO2的分子晶体转化为原子晶体是化学变化
B.CO2的原子晶体和分子晶体实际上是同种物质
C.CO2的原子晶体和分子晶体具有相同的物理性质
D.在CO2的原子晶体中,每一个C原子周围结合4个O原子
13.(华附5月月考)某元素的某种含氧酸的阴离子符号是RO3-,则该元素的气态氢化物的化学式可能是
A.HR B.H2R C.RH3 D.RH4
10、(华附5月月考)下列各组分子中,都属于含极性键的非极性分子的是
A.CO2、H2S B.C2H4、CH4 C. C60、C2H4 D.NH3、HCl
8、(华附5月月考)氯化硼的熔点为-107℃,沸点为12.5℃,在其分子中键与键之间的夹角为120o,它能水解,有关叙述不正确的是
A.氯化硼液态时能导电而固态时不导电
B.氯化硼加到水中使溶液的pH降低
C.氯化硼分子呈正三角形,属非极性分子
D.氯化硼遇水蒸气会产生白雾
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com