
题目列表(包括答案和解析)
29.(广东省肇庆一模)(10分)水是生命之源,也是一种常用的试剂。请回答下列问题:
(1)水分子中氧原子在基态时核外电子排布式为___ _______;
(2)H2O分子中氧原子采取的是 杂化。
(3)水分子容易得到一个H+形成水合氢离子(H3O+)。对上述过程的下列描述不合理的是 。
A.氧原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.水分子仍保留它的化学性质 D.微粒中的键角发生了改变
(4)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是______(请用相应的编号填写)


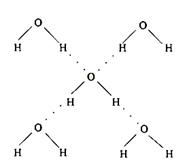 (5)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是_________kJ/mol;
(5)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是_________kJ/mol;
(6)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子。请写出生成此配合离子的离子方程式: 。
(7)分析下表数据,请写出你出的最具概括性的结论:
① ;
② 。
|
键型 |
键能 (kJ/mol) |
键长 (pm) |
分子 |
键角 |
物质 |
熔点(℃) |
沸点(℃) |
|
H-C |
413 |
109 |
 |
109.5º |
甲烷 |
-183.7 |
-128.0 |
|
H-N |
393 |
101 |
 |
107 º |
氨 |
-77.7 |
-33.3 |
|
H-O |
463 |
96 |
 |
104.5 º |
水 |
0.0 |
100.0 |
21.(广东省肇庆一模)(8分)学习了元素周期表后,同学们对第四周期过渡元素产生了浓厚的兴趣。是否只有MnO2能催化KClO3受热分解?CuO、Fe2O3、Cr2O3等对氯酸钾的受热分解有没有催化作用?若有催化作用效率怎样?请你与他们一起进行实验探究:
I 课题名称:____________________________________________________________。
II实验仪器及试剂:实验仪器:带铁夹的铁架台、带橡皮塞的导管、量气装置、过滤装置、电子天平、药匙、大试管、 、 等。
实验试剂:二氧化锰、氧化铁、氧化铜、氧化铬和氯酸钾
III 实验步骤:略 IV 实验数据:
|
实验 编号 |
KClO3(g) |
氧化物 |
产生气体(mL) |
耗时(s) |
||
|
化学式 |
质量(g) |
回收 |
(已折算为标况) |
|||
|
1 |
0.60 |
- |
- |
- |
10 |
480 |
|
2 |
0.60 |
MnO2 |
0.20 |
90% |
67.2 |
36.5 |
|
3 |
0.60 |
CuO |
0.20 |
90% |
67.2 |
79.5 |
|
4 |
0.60 |
Fe2O3 |
0.20 |
90% |
67.2 |
34.7 |
|
5 |
0.60 |
Cr2O3 |
0.20 |
异常 |
67.2 |
188.3 |
V 实验讨论:(1)实验编号3的实验中KClO3的分解率为_________%(保留一位小数)。
(2)在用Cr2O3 做研究实验时,发现有刺激性气味的气体产生,同时绿色的混合物变成了橘黄色。该刺激性气体是________(填分子式),可用______________试纸检验。上述异常现象产生的原因是____________ _______________________。
VI 实验结论:_____________________________________________________________
27.(10分) (1)1s22s22p63s23p63d104s1 (2) 2 2
(3)三角锥形; [Cu(NH3)4]2+,配位键
(4)HNO3; HNO3是极性分子,易溶于极性的水中; HNO3分子中的-OH易与水分子之间形成氢键
28(B). (东莞一模)(10分)A、B、C、D、E都是短周期元素,原子序数依次增大,B、C同周期,C的非金属性最强,A、D同主族隔周期,E元素原子最外层的p亚层电子数是s亚层电子数的一半。A、B能形成两种液态化合物甲和乙,原子个数比分别为2∶1和1∶1。根据以上信息回答下列问题:
⑴甲、乙两分子中含有非极性共价键的物质的电子式是________________ ,
C元素在周期表中的位置是__________________。
⑵C和D的离子中,半径较小的是__________(填离子符号)。
⑶将D的单质投入甲中,待D消失后再向上述溶液中加入E的单质,此时发生反应的化学方程式是_____________ ________ __ _____________
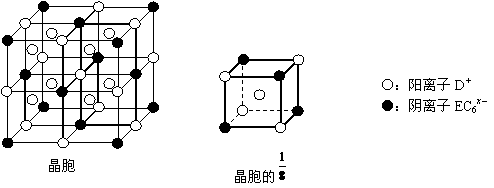
⑷C、D、E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如下图所示,阳离子D+(用○表示)位于正方体的棱的中点和正方体内部;阴离子EC6x-(用●表示)位于该正方体的顶点和面心。该化合物的化学式是_________ 。
(5)如图,铁有δ、γ、α三种同素异形体,三种晶体在不同温度下能发生转化。下列说法正确的是( )
A.γ-Fe晶体中与每个铁 原子距离相等且最近的铁原子有6个
B.α-Fe晶体中与每个铁原子距离相等且最近的铁原子有6个
C. 若δ-Fe晶胞边长为acm,α-Fe晶胞边长为bcm,则两种晶体密度比为2b3:a3
 D.将铁加热到1500℃分别急速冷却和缓慢冷却,得到的晶体类型相同
D.将铁加热到1500℃分别急速冷却和缓慢冷却,得到的晶体类型相同
28(B).(10分)(1)⑴ (1分) 第二周期、第ⅦA族 (2分)
(1分) 第二周期、第ⅦA族 (2分)
⑵ Na+ (1分) ⑶ 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ (2分) ⑷ Na3AlF6 (2分) (5) B C(2分,选1个且正确的给1分,错选一个该题0分,)
27.(汕头一模)(10分) 下图是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。
 (1)请写出上图中d单质对应元素原子基态时的电子排布式
。
(1)请写出上图中d单质对应元素原子基态时的电子排布式
。
(2)单质a、f、b对应的元素以原子个数比1:1:1 形成的分子中含 个 键, 个
键, 个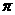 键。
键。
 (3)a与b的元素形成的10电子中性分子X的空间构型为
;将X溶于水后的溶液滴入到含d元素高价离子的溶液中至过量,生成的含d元素离子的化学式为
,其中X与d的高价离子之间以
(3)a与b的元素形成的10电子中性分子X的空间构型为
;将X溶于水后的溶液滴入到含d元素高价离子的溶液中至过量,生成的含d元素离子的化学式为
,其中X与d的高价离子之间以
键结合。
(4)上述六种元素中的一种元素形成的含氧酸的结构为:
该含氧酸的分子式为: ,请简要说明该物质易溶于水的原因 。
29、(前6空每空1分,后两空每空2分,共10分)
|
(3)有无色气体产生 2H2O2===2H2O+O2↑ (4)CH4O。
29、(广东省珠海一模)已知A、B、C、D和E五种分子所含原子的数目依次为1、2、3、4和6,且都含有18个电子,又知B、C和D是由两种元素的原子组成,且D分子中两种原子个数比为1:1。
请回答:
(1) 组成A分子的原子的核外电子排布式是 ;
(2) B和C的分子式分别是 和 ;C分子的立体结构呈 形,该分子属于 分子(填“极性”或“非极性”);
(3) 向D的稀溶液中加入少量氯化铁溶液现象是 ,该反应的化学方程式为
(4) 若将1molE在氧气中完全燃烧,只生成1molCO2和2molH2O,则E的分子式是 。
29.(10分)
(1)1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p3 (2分)
(2)配位键(1分) CN-能提供孤对电子,Fe3+能接受孤对电子(或Fe3+有空轨道)(1分)
(3)① 结构相似时,相对分子质量越大,分子间作用力越大,因此SiH4沸点高于CH4 ;NH3分子间还存在氢键作用,因此NH3的沸点高于PH3。 (2分)
② C-H键键能大于Si-H键,因此CH4分解温度高于SiH4;N-H键键能大于P-H键,因此NH3分解温度高于PH3。 (2分)
HF (2分)
29.(广东省广州市一模)(10分)
氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用。请回答下列问题。
(1)砷原子核外电子排布式为________________________________________。
(2)K3[Fe(CN)6]晶体中Fe3+与CN-之间的键型为_________________,该化学键能够形成的原因是_______________________________________________________________________。
(4)已知:
|
|
CH4 |
SiH4 |
NH3 |
PH3 |
|
沸点(K) |
101.7 |
161.2 |
239.7 |
185.4 |
|
分解温度(K) |
873 |
773 |
1073 |
713.2 |
分析上表中四种物质的相关数据,请回答:
① CH4和SiH4比较,NH3和PH3比较,沸点高低的原因是________________________
______________________________________________________________________。
② CH4和SiH4比较,NH3和PH3比较,分解温度高低的原因是____________________
_________________________________________________________________________。
结合上述数据和规律判断,一定压强下HF和HCl的混合气体降温时__________先液化。
27、(每空2分,共10分)
(1)6;
(2)O=C=C=C=O;
(3)[Ar]3d10;
(4)2;
(5)
27、(深圳市宝安区一模)(10分)下面的表格是元素周期表的一部分,其中的字母对应不同的元素。
|
A |
|
|
|||||||||||||||
|
|
|
|
|
M |
Q |
R |
|
|
|||||||||
|
|
|
E |
|
|
|
D |
|
||||||||||
|
|
|
|
G |
|
|
|
J |
|
|
L |
|
|
|
|
|
|
|
请回答下列问题:
(1)G和J形成的合金是一种贮氢材料,其晶体结构与氯化铯相同。该合金中每个G原子周围与其最近且等距的G原子有 个。
(2)M3R2是一种直线型分子,分子中每个原子均达到八电子稳定结构,则其结构式为: 。(用元素符号表示)
(3)L元素有多种可变化合价,请写出L+的电子排布式: 。
(4)AMQ也是直线型分子,则其分子中含有 个π键。
(5)化合物D2E6分子中各原子均达到了八电子稳定结构,请画出其结构式。(用元素符号表示)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com