
题目列表(包括答案和解析)
4.(广东省茂名一模)NA表示阿伏加德罗常数,下列叙述中正确的是
A.0.1mol Fe与0.lmol Cl2充分反应,转移的电子数为0.3NA
B.标准状况下,11.2LNO2和11.2LN2O4的混合,平衡时所含的分子数为l.5NA
C.2.0gD20中所含中子数为0.1NA
D.常温常压下, 229 氧气和 269 臭氧所含氧原子总数为 3N ^
3.(广东省梅州一模)阿伏加德罗常数约为NA,下列说法不正确的是 ( )
A.1L 0.5 mol/L CH3COONa溶液中含有的CH3COO-个数为0.5 NA
B.6.2g白磷P4中所含的P-P键的个数为0.3 NA
C.在标准状况下,V L CH2O中含有的氧原子个数为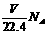
D.常温常压下,22g氧气和26g臭氧所含氧原子总数为3 NA
2.(广东省深圳一模)将等物质的量的F2和ClF混合,在密闭容器中发生反应: F2(g)+ClF(g)≒ClF3(g);△H<0。下列叙述中,正确的是
A.恒温恒容时,当ClF 转化40% 时,容器内的压强为初始时的0.8 倍
B.若 c(F2):c (ClF): c (ClF3) =1: 1: 1, 则反应一定达到平衡状态
C.达到平衡后,若增大容器体积,则正反应速率减小,逆反应速率增大,平衡左移
D.平衡后再降低温度,保持恒容,达到新的平衡,则混合气体的平均摩尔质量增大
1.(广东省深圳一模)NA代表阿伏加德罗常数。下列说法中,不正确的是
A.标准状况下,NO和 O2各11.2 L 混合,所得混合气体的分子总数为 0.75 NA
B.25℃时,l L pH=13的Ba(OH)2 溶液中含有OH―的数目为0.1 NA
C.1 mol C30H62 分子中含有共价键的数目为 91 NA
D.2.8g 乙烯与丙烯的混合物中含碳原子的数目为 0.2NA
29.(共10分)
(1)LaNi5
+ 3H2  LaNi5H6;(2分,不配平不给分,化学式不正确不给分,可逆符号写等号扣一分)
LaNi5H6;(2分,不配平不给分,化学式不正确不给分,可逆符号写等号扣一分)
(2)CE (2分,每选对一个给一分,每错选一个倒扣一分,扣完本小题分为止)
(3)①[Ar]3d7;或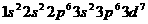 (2分,写成3d7不给分)
(2分,写成3d7不给分)
②2NiO(OH) + 6HCl(浓)=2NiCl2+Cl2↑+4H2O;(2分,未配平不给分,氯气未写气体符号扣一分)
(4)A和B(或A和C、A和D、B和E、C和E、D和E任一组均可);(2分,若同组中出现同种物质则不给分,例如AE、BC……等)
29.(广东省深圳一模)(10 分 )
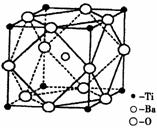
氢是新型清洁能源,但难储运。研究发现,合金可用来储藏氢气。镧( ) 和镍(
) 和镍(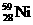 ) 的一种合金就是储氢材料。该合金的晶胞如右图,镍原子除一个在中心外,其他都在面上,镧原子在顶点上。储氢时氢原子存在于金属原子之间的空隙中。
) 的一种合金就是储氢材料。该合金的晶胞如右图,镍原子除一个在中心外,其他都在面上,镧原子在顶点上。储氢时氢原子存在于金属原子之间的空隙中。
(1)一定条件下,该贮氢材料能快速、可逆地存储和释放氢气,若每个晶胞可吸收 3 个 H2, 这一过程用化学方程式表示为: 。
(2)下列关于该贮氢材料及氢气的说法中,正确的是 ( 填序号 )
A.该材料中镧原子和镍原子之间存在化学键,是原子晶体
B.氢分子被吸收时首先要在合金表面解离变成氢原子,同时放出热量
C.该材料贮氢时采用常温高压比采用常温常压更好
D.氢气很难液化是因为虽然其分子内氢键很强,但其分子间作用力很弱
E.己知镧和镍的第一电离能分别为 5.58eV、7.64eV, 可见气态镧原子比气态镍原子更容易变成+1 价的气态阳离子
(3)某研究性学习小组查阅的有关镍及其化合物的性质资料如下:
|

①写出 Ni3+ 的核外电子排布式:
②写出将NiO(OH) 溶于浓盐酸的离子方程式:
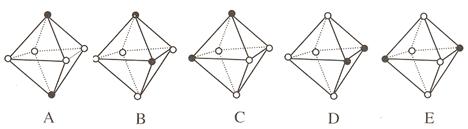
(4)Ni(CO)6为正八面体结构,镍原子位于正八面体的中心,配位体CO在正八面体的六个顶点上。若把其中两个CO配位体换成 NH3 得到新的配合物,则以下物质中互为同分异构体的是 。 ( 填字母编号,任填一组 )( 图中黑点为NH3,圆圈为CO,Ni略去)
29.I.IIIA (2分)
II.IVA;(1分)b;(1分)a点所示的氢化物是水,其沸点高是由于在水分子间存在多条结合力较大的氢键,总强度远远大于分子间作用力,所以氧族元素中其它氢化物的沸点不会高于水。(2分)
III.(1)3d24s2。(1分)(2)①BaTiO3;(3分)
29.(广东省梅州一模)(10分)《物质结构与性质》图表法、图象法是常用的科学研究方法。
I.短周期某主族元素M的电离能情况如图(A)所示,则M元素位于周期表的第______族。
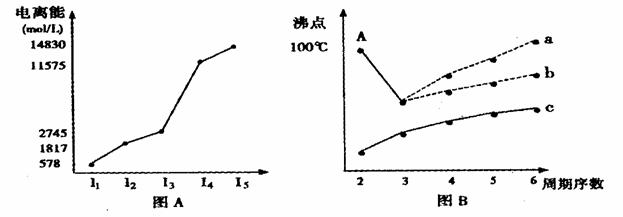
II. 图B是研究部分元素的氢化物的沸点变化规律的图像,折线c可以表达出第_______族元素氢化物的沸点的变化规律。不同同学对某主族元素氢化物的沸点的变化趋势画出了两条折线--折线a和折线b,你认为正确的是:______,理由是:_______________
_________________________________________________________________________。
III.人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属则被科学家预测为是钛(Ti)。钛被誉为“未来世纪的金属”。试回答下列问题:
 (1) 22Ti元素基态原子的价电子层排布式为________。第四周期的_________________元素具有和Ti相同的未成对电子数。
(1) 22Ti元素基态原子的价电子层排布式为________。第四周期的_________________元素具有和Ti相同的未成对电子数。
(2) 在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中
以+4价的Ti最为稳定。偏钛酸钡的热稳定性好,介电常数
高,在小型变压器、话筒和扩音器中都有应用。偏钛酸钡晶
体中晶胞的结构示意图如右图,则它的化学式是__________。
29、(10分) (l) 4s24p3( l 分) (2)共价键(或σ键) (l分)
(3) 4 (l分)正四面体(l分)原子(2分) (4) Si一O大于C一O的键,C=O的键能大于Si=O的键能,所以Si和O成单键,而C和O以双键形成稳定分子( 2 分)
(5)SiCl4(l) + 3H2O (l) = H2SiO3 (s) + 4HCl(aq) ( 2 分)
29、(广东省茂名一模)(10分)Al和Si、Ge和As在元素周期表金属和非金属过渡位置上,在其单质和化合物在建筑业、电子工业和石油化工等方面应用广泛。请回答下列问题:
(1) As 的价层电子构型为
(2) AlCl3是化工生产中的常用催化剂,熔点为192.6℃,熔融状态以二聚体A12C16形式存在,其中铝原子与氯原子的成键类型是
(3)超高导热绝缘耐高温纳米氮化铝(AlN)在绝缘材料中的应用广泛,AlN晶体与金刚石类似,每个Al原子与个N原子相连,与同一个Al原子相连的N原子构成的空间构型为。在四大晶体类型中,AlN属于 晶体。
(4)Si和C 同主族,Si、C和0成键情况如下:
在C和O之间可以形成双键形成CO2分子,而Si和O则不能和碳那样形成有限分子原因是
(5)SiCl4(l)常用作烟雾剂,原因Si存在3d轨道,能同H20 (l)配位而剧烈水解,在潮湿的空气中发烟,试用化学方程式表示其原理
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com