
题目列表(包括答案和解析)
11.(8分)(1)略
(2)NO与NH3的物质的量0.8mol 0.2mol; 0.3mol 0.7mol
11.(8分)在一定条件下,NO跟NH3可以发生反应生成N2和H2O。现有NO和NH3的混合物1mol,充分反应后所得产物中,若经还原得到的N2比经氧化得到的N2多1.4g。
(1)写出反应的化学方程式并用双线桥标出电子转移方向和数目。
(2)若以上反应进行完全,试计算原反应混合物中NO与NH3的物质的量各是多少?
10.(1)Na2CO3 NaOH;(2分) 0.5mol 0.5m mol(2分)
(2)1/3≤x≤12(3分)
(3)n=mcl-3x/27(4分)
10.(13分)将mmolNa2O2和NaHCO3的混合物在密闭容器中加热至250℃,使其充分反应,混合物中Na2O2的物质的量分数为X。
(1)当X=1/2时,容器中固体产物 (写化学式),其物质的量为 。
(2)若反应后生成的气体为O2和H2O,则X的取值范围 。
(3)当0<X<1/3时,产生气体的物质的量n的数字表达式(用m、x表示) 。
9. (1)5.8 5.4 (2)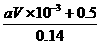 (3)57.8
(3)57.8
9.(共12分)将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2 混合气体在标准状况下的体积为11.2L。请回答:
(1)NO的体积为________L,NO2的体积为________L。
(2)待产生的气体全部释放后,向溶液中加入VmL amol/L的NaOH溶液,恰好使
溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为________ mol/L。
(3)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要
30%的双氧水________g。
8. ⑴0.5
⑵n(O2)=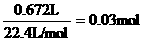 n(H2O2)=0.06mol
n(H2O2)=0.06mol
由实验Ⅰ中数据可知,5mLA溶液中:
n(Na2CO3)=n(CO2)= 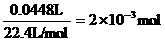
所以100mLA中含有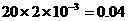 mol n(Na2CO3) ∶ n(H2O2)=0.04:0.06=2:3
mol n(Na2CO3) ∶ n(H2O2)=0.04:0.06=2:3
所以化学式为2Na2CO3·3H2O2)
⑶据题意可得:
n(H2O2)= n(Na2S2O3) /2=0.1mol/L×0.033L/2=1.65×10-3mol
该过碳酸钠的活性氧的质量分数为:
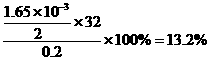 >13%
>13%
所以该过碳酸钠样品为优等品。
8、 过碳酸钠是一种有多用途的新型氧系漂白剂,化学式可表示为aNa2CO3·bH2O2。现将一定质量的过碳酸钠粉末溶于水配成稀溶液,再向其中加入适量MnO2粉末,充分反应后生成672mL气体(标准状况)。反应后的混合物经过滤、洗涤后,将滤液和洗涤液混合并加水配成100mL溶液A。现向三份体积为10mL、浓度为cmol/L的稀硫酸中分别逐滴滴入溶液A,边滴边振荡,充分反应后,测得实验数据如
下表所示:
|
实验序号 |
Ⅰ |
Ⅱ |
Ⅲ |
|
滴加溶液A的体积/mL |
5.0 |
10.0 |
15.0 |
|
生成气体的体积/mL(标准状况) |
44.8 |
89.6 |
112 |
⑴稀硫酸的物质的量浓度c= 。
⑵通过计算确定过碳酸钠的化学式。
⑶工业上常以所含活性氧的质量分数[w(活性氧)=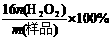 ]来衡量过碳酸钠产品的优劣,13%以上者为优等品。现将0.2g某厂家生产的过碳酸钠样品(所含杂质不参与后面的氧化还原反应)溶于水配成溶液,加入15.0mL 1mol/L硫酸,再加入足量KI,摇匀后置于暗处,充分反应后,加入少量淀粉试液,用0.1mol/L
Na2S2O3溶液滴定到蓝色恰好消失时,共消耗33.00mL,试计算判断该样品是否为优等品。(已知:2Na2S2O3+I2=Na2S4O6+2NaI)
]来衡量过碳酸钠产品的优劣,13%以上者为优等品。现将0.2g某厂家生产的过碳酸钠样品(所含杂质不参与后面的氧化还原反应)溶于水配成溶液,加入15.0mL 1mol/L硫酸,再加入足量KI,摇匀后置于暗处,充分反应后,加入少量淀粉试液,用0.1mol/L
Na2S2O3溶液滴定到蓝色恰好消失时,共消耗33.00mL,试计算判断该样品是否为优等品。(已知:2Na2S2O3+I2=Na2S4O6+2NaI)
7、(5分)( 4×l0-3 mol / L)
7、(5分)将两个铂电极插入500 mL CuSO4溶液中进行电解,通电一定时间后,某一电极增重0.064 g(设电解时该电极无氢气析出,且不考虑水解和溶液体积变化)。计算此时溶液中氢离子浓度约为多少?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com