
题目列表(包括答案和解析)
25、下列推论正确的是C
A.S(g)+O2(g)=SO2(g) △H1,S(s)+O2(g)=SO2(g) △H2;则:△H1>△H2
B.C(石墨,s)=C(金刚石,s) △H =+1.9kJ/mol,则:由石墨制取金刚石的反应是吸热反应,金刚石比石墨稳定
C.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H =-57.4kJ/mol,则:含20gNaOH的溶液与稀盐酸完全反应,放出的热量为28.7kJ
D.CaCO3(s)=CaO(s)+CO2(g) △H >0,△S>0,则:该反应任何温度下都能自发进行
24.已知:①1molH2分子中化学键断裂时需要吸收436kJ的能量
②①1molCl2分子中化学键断裂时需要吸收243kJ的能量
③由H原子和Cl原子形成1molHCl分子时释放431kJ的能量
下列叙述正确的是( C )
A.氢气和氯气反应生成氯化氢气体的热化学方程式是H2(g)+Cl2(g)=2HCl(g)
B.氢气与氯气反应生成2mol氯化氢气体,反应的△H=183kJ/mol
C.氢气与氯气反应生成2mol氯化氢气体,反应的△H=-183kJ/mol
D.氢气与氯气反应生成1mol氯化氢气体,反应的△H=-183kJ/mol
23.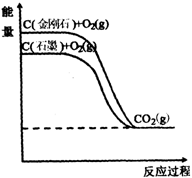 分析右图所示各物质能量变化关系,下列热化学
分析右图所示各物质能量变化关系,下列热化学
方程式正确的是( A )
A.C(金刚石)+O2(g)=CO2(g); ΔH1=a kJ/mol(a<0)
B.C(石墨)+O2(g)=CO2(g); ΔH2=b kJ/mol(b>0)
C.C+O2=CO2(g); ΔH3=c kJ/mol(c<0)
D.C(金刚石)=C(石墨); ΔH4=d kJ/mol(d>0)
22、标准状况下将纯净的CH41L在空气中完全燃烧,生成CO2气和液态水,放出39.75kJ热量,则CH4燃烧的热化方程式为C
A.CH4(g)+2O2(g)→CO2(g)+2H2O(l);△H=-39.75kJ/mol
B.CH4(g)+2O2(g)→CO2(g)+2H2O(l);△H=890.4kJ/mol
C.CH4(g)+2O2(g)→CO2(g)+2H2O(l);△H=-890.4kJ/mol
D.CH4(g)+2O2(g)→CO2(g)+2H2O(l);△H=39.75kJ/mol
21.肼(N2H4)是火箭发动机的燃料,反应时N2O4为氧化剂,生成氮气和水蒸气。已知:
N2(g)+2O2(g)=N2O4(g);△H=+8.7kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-534.0kJ/mol
下列表示肼跟N2O4反应的热化学方程式,正确的是 ( C )
A.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g);△H=-542.7kJ/mol
B.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g);△H=-1059.3kJ/mol
C.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g);△H=-1076.7kJ/mol
D.N2H4(g)+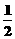 N2O4(g)=
N2O4(g)= N2(g)+2H2O(g);△H=-1076.7kJ/mol
N2(g)+2H2O(g);△H=-1076.7kJ/mol
20.已知25℃、101KPa条件下:
4Al(s) + 3O2(g) = 2Al2O3(s);△H=-2834.9KJ/mol
4Al(s) + 2O3(g) = 2Al2O3(s);△H=-3119.1KJ/mol
由此可以得出的结论是A
A.等质量的O2比O3的能量低,由O2变O3为吸热反应
B.等质量的O2比O3的能量低,由O2变O3为放热反应
C.O3比O2稳定,由O2变O3为吸热反应
D.O2比O3稳定,由O2变O3为放热反应
19.已知一定温度和压强下,合成氨反应:N2(g)+3H2(g)
 2NH3(g);△H=-92.0KJ·mol-1
2NH3(g);△H=-92.0KJ·mol-1
将1mol N2和3mol H2充入一密闭容器中,保持恒温恒压,在催化剂存在时进行反应,达到平衡时,测得N2的转化率为20%。若在相同条件下,起始时在该容器中充入2mol NH3,反应达到平衡时的热量变化是( C )
A.吸收18.4KJ热量 B.放出18.4KJ热量
C.吸收73.6KJ热量 D.放出73.6KJ热量
18.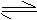 参照反应Br+H2 HBr+H的能量对反应
参照反应Br+H2 HBr+H的能量对反应
历程的示意图,下列叙述中正确的是( A )
A. 正反应为吸热反应
B.
加入催化剂,该化学反应的反应热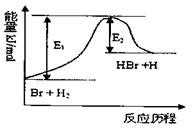
变大
C. 反应物总能量高于生成物总总量
D. 升高温度可增大正反应速率,降低
逆反应速率
17.下列说法或表示方法正确的是 ( C )
A.反应物的总能量低于生成物的总能量时,该反应一定不能发生
B.中和热一定是强酸跟强碱反应放出的热量
C.由石墨比金刚石稳定可知: C(金刚石)== C(石墨);ΔH<0
D.在101 kPa、25℃时,2g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式可表示为:2H2(g) + O2(g) == 2H2O(l);ΔH=-285.8 kJ/ mol
16、已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是285.8 kJ·mol-1、1411.0 kJ·mol-1和1366.8 kJ mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为A
A.-44.2 kJ·mol-1 B.+44.2 kJ·mol-1
C.-330 kJ·mol-1 D.+330 kJ·mol-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com