
题目列表(包括答案和解析)
5、今有如下三个热化学方程式。
H2(g) + 1/2O2(g) == H2O(g) ;△H1 H2(g) + 1/2O2(g) == H2O(l) ;△H2
2H2(g) +O2(g) == 2H2O(g) ;△H3 H2O(l) == H2O(g);△H4
关于它们的下列表述正确的是( AD )
A.△H4 = △H1-△H2 B. △H1 △H2 △H3 △H4均为负值
C.△H1= △H2 D.2△H1 = △H3
4.下列说法中正确的是C
A.在相同条件下,若将等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由“C(石墨)=C(金刚石);ΔH = +119kJ·mol-1 ”可知,金刚石比石墨稳定
C.在稀溶液中:H+(aq)+OH-(aq)=H2O(l);ΔH = -57.3l kJ·mol-1,若将含0.5mol H2SO4的浓硫酸与lmol NaOH溶液混合,放出的热量大于57.31 kJ
D.在101KPa时,2g H2完全燃烧生成液态水,放出285.8 kJ 热量,氢气燃烧的热化学方程式表示为:H2(g)+1/2O2(g)=H2O(l);ΔH = + 285.8 kJ·mol-1
3、甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是 ①CH3OH(g)+H2O(g)=CO2(g)+3H2(g);△H=+49.0kJ·mol-1 ②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g);△H=-192.9kJ·mol-1 下列说法正确的是D
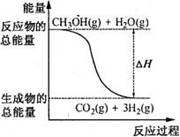 A.CH3OH的燃烧热为192.9kJ·mol-1
B.反应①中的能量变化如右图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)
A.CH3OH的燃烧热为192.9kJ·mol-1
B.反应①中的能量变化如右图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)
的△H>-192.9kJ·mol-1
2.灰锡(以粉末状存在)和白锡是锡的两种同素异形体。已知:
①Sn(s、白)+2HCl(aq)=SnCl2(aq)+H2(g) △H1
②Sn(s、灰)+2HCl(aq)=SnCl2(aq)+H2(g) △H2
③Sn(s、灰)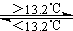 Sn(s、白)
△H3=+2.1kJ/mol
Sn(s、白)
△H3=+2.1kJ/mol
下列说法正确的是D
A.△H1>△H2
B.锡在常温下以灰锡状态存在
C.灰锡转化为白锡的反应是放热反应
D.锡制器皿长期处于低于13.2℃的环境中,会自行毁坏
1.一定条件下,2CO(g) + O2(g) = 2CO2(g);⊿H=-566 kJ·mol-1;CH4(g)+2O2(g)=CO2(g)+2H2O(l);
⊿H=-890 kJ·mol-1,则1molCO和3molCH4组成的混合气体在上述条件下完全燃烧放出的热量为B
A.2912 kJ B.2953 kJ C.3236 kJ D.3836 kJ
28、(1)1/2H2SO4(aq)+ 1/2 Ba(OH)2(aq)== 1/2BaSO4(s)+H2O(1);△H=-57.3kJ/mol
H+(aq)+OH-(aq)=H2O(1);△H = -57.3kJ·mol-1(3分,物质、状态、反应热各1分)
(2)环形玻璃搅拌棒(2分) 偏大(2分)
(3)-51.8 kJ/mol(2分)
(4)不能(1分)H2SO4与Ba(OH)2反应生成的BaSO4沉淀的生成热会影响反应的反应热(2分)
本资料由《七彩教育网》 提供!
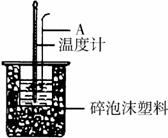
28、(12分)分别取40mL的0.50mol/L盐酸与40mL 0.55mol/L氢氧化钠溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题。
 (1)理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式
;
(1)理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式
;
(2)如右图所示,仪器A的名称是_______________;在实验过程中,
如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,则测得
的△H (填“偏大”、“偏小”或“无影响”);
(3)假设盐酸和氢氧化钠溶液的密度都是1g/cm3,又知中和后生成溶液
的比热容c=4.18J/(g·℃)。为了计算中和热,某学生实验记录数据如下:
|
实验序号 |
起始温度t1℃ |
终止温度t2℃ |
|
|
盐酸 |
氢氧化钠 |
混合溶液 |
|
|
1 |
20.0 |
20.1 |
23.2 |
|
2 |
20.2 |
20.4 |
23.4 |
|
3 |
20.5 |
20.6 |
23.6 |
依据该学生的实验数据计算,该实验测得的中和热△H=____________________;(结果保留一位小数)
(4) (填“能”或“不能”)用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液,理由是 。
27、放出185KJ的能量;H2(g) + Cl2(g)= 2HCl(g);ΔH = - 185KJ/ mol。
27、(4分)在氢气与氯气反应生成氯化氢气体的反应中,若断裂1mol H - H键要吸收436KJ的能量,断裂1mol Cl- Cl键要吸收243KJ的能量,断裂1molH - Cl键要吸收432KJ的能量,则充分燃烧1mol H2 的能量变化是 。 若 ΔH〈 0代表放热,ΔH 〉0代表吸热,该化学反应的热化学方程式是
26.下列说法或表示方法正确的是(B )
A.需要加热发生的反应是吸热反应
B.在稀溶液中:H+(aq)+OH-(aq)=H2O(l);△H = –57.3kJ/mol,若将含0.5mol H2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量大于57.3kJ
C.由C(石墨)→C(金刚石);△H = +73 kJ/mol,可知金刚石比石墨稳定
D.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l);△H = +285.8kJ/mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com