
题目列表(包括答案和解析)
15.已知反应:(1)C(s)+ O2(g)== CO2(g) △H = -393.5kJ/mol
(2)2CO(g)+ O2(g)== 2CO2(g) △H = -566.0kJ/mol
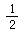 则反应:C(s)+ O2(g)== CO(g)的△H 是B
则反应:C(s)+ O2(g)== CO(g)的△H 是B
A.-221 kJ/mol B.-110.5 kJ/mol
C.+110.5 kJ/mol D.+221 kJ/mol
|
化学键 |
Si-O |
O=O |
Si-Si |
|
键能/kJ·mol-1 |
X |
498.8 |
176 |
14.通常人们把拆开1 mol某化学键吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以估计化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。下列是一些化学键的键能。A
|
化学键 |
C-H |
C-F |
H-F |
F-F |
键能/(kJ·mol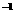 ) ) |
414 |
489 |
565 |
155 |
根据键能数据估算下列反应的反应热ΔH为:CH4 (g)+4F2 (g) =CF4+4HF(g) ( )
A.–1940 kJ · mol-1 B.1940 kJ · mol-1
C. –485 kJ · mol-1 D.485 kJ · mol-1
13.下列有关热化学方程式的叙述正确的是( C )
A.已知2H2(g)+O2(g) 2H2O(g);△H=-483.6kJ/mol,则氢气的燃烧热为241.8 kJ/mol
2H2O(g);△H=-483.6kJ/mol,则氢气的燃烧热为241.8 kJ/mol
B.已知C(石墨,s) C(金刚石,s);△H>0,则金刚石比石墨稳定
C(金刚石,s);△H>0,则金刚石比石墨稳定
C.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为:NaOH(aq)+HCl(aq) NaCl(aq)+H2O(l);△H=-57.4kJ/mol
NaCl(aq)+H2O(l);△H=-57.4kJ/mol
D.己知2C(s)+2O2(g)=2CO2(g);△H1 2C(s)+O2(g)=2CO(g);△H2
则△H1>△H2
12、化学反应N2+3H2 = 2NH3的能量变化如题13图所示,该反应的热化学方程式是( B )
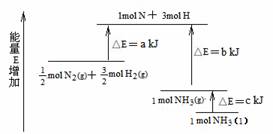
A.N2(g)+3H2(g) = 2NH3(g) ;⊿H = 2(b-a)kJ·mol-1
B. N2(g)+3H2(g) = 2NH3(l);⊿H = 2(a-b-c)kJ·mol-1
C.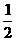 N2(g)+
N2(g)+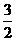 H2(g) = NH3(l) ;⊿H = (b+c-a)kJ·mol-1
H2(g) = NH3(l) ;⊿H = (b+c-a)kJ·mol-1
D.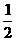 N2(g)+
N2(g)+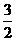 H2(g) =NH3(g) ;⊿H = (a+b)kJ·mol-1
H2(g) =NH3(g) ;⊿H = (a+b)kJ·mol-1
11.充分燃烧一定量丁烷气体放热QkJ,完全吸收它产生的CO2且生成正盐,需5mol/L的KOH溶液100mL。则丁烷的燃烧热为( A )
A.16QkJ/mol B.8QkJ/mol C.-8QkJ/mol D.-16QkJ/mol
10.一定条件下,用甲烷可以消除氮氧化物(NOx)的污染。已知:
① CH4 (g)+4NO2 (g)=4NO (g) +CO2 (g)+2H2O (g) ;△H=―574 kJ·mol-1
② CH4 (g)+4NO (g)=2N2 (g)+CO2 (g)+2H2O (g) ;△H=―1160 kJ·mol一1。
下列选项正确的是( BD )
A.CH4 (g)+2NO2 (g)= N2 (g)+CO2 (g)+2H2O (l) ;△H=―867 kJ·mol-1
B.若0.2 mol CH4还原NO2至N2,在上述条件下放出的热量为173.4 kJ
C.1molCH4催化还原NOx为N2的过程中,若x=1.6,则转移的电子为3.2 mol
D.若用标准状况下2.24L CH4还原NO2至N2,整个过程中转移的电子为0.8 mol
9.己知:①2C(s)+O2(g)=2CO(g);△H1 ② 2CO(g)+O2(g)=2CO2(g);△H2 。下列说法中正确的是 ( C )
A.碳的燃烧热为0.5△H1kJ/mol B.②为能表示CO燃烧热的热化学方程式
C.碳的燃烧热△H=0.5(△H1+△H2) D.碳的燃烧热小于CO的燃烧热
8.长征二号捆绑式火箭推进剂以肼(N2H4)作为燃料,NO2作为氧化剂,反应生成N2和水蒸气。已知:N2(g) + 2O2(g) =2NO2(g); △H=+67.7 kJ/mol
N2H4(g) + O2(g) = N2(g) + 2H2O(g); △H=-534 kJ/mol
下列关于肼和NO2反应的热化学方程式中,正确的是B
A.2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(l);△H=-1135.7 kJ/mol
B.N2H4(g) + NO2(g) = 3/2N2(g) + 2H2O(g);△H=-567.85 kJ/mol
C.N2H4(g) + NO2(g) = 3/2N2(g) + 2H2O(l);△H=-1135.7 kJ/mol
D.2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(g); △H=+1135.7 kJ/mol
7.已知反应:①101kPa时,2C(s)+O2(g)=2CO(g); △H=-221kJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(1);△H=-57.3kJ/mol
③红磷的化学式为P,白磷的化学式为P4,已知
P4(s)+5O2(g)=P4O10(s);△H=-3093.5kJ/mol
4P(s)+5O2(g)=P4O10(s);△H=-2954.0kJ/mol
下列结论正确的是 ( B )
A.由于红磷转化为白磷是放热反应,等质量的红磷能量比白磷低
B.碳的燃烧热大于110.5kJ/mol
C.稀硫酸与稀NaOH溶液反应的中和热△H=57.3kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量
6、已知2SO2(g)+ O2(g)  2SO3(g);△H=-197kJ/mol,同温下,往相同体积的密闭容器甲、乙中分别充入2molSO2、1molO2 和1molSO3、1molSO2、0.5mol O2,当它们分别达到平衡时放出的热量为Q1
KJ和Q2KJ,则下列比较正确的是( C )
2SO3(g);△H=-197kJ/mol,同温下,往相同体积的密闭容器甲、乙中分别充入2molSO2、1molO2 和1molSO3、1molSO2、0.5mol O2,当它们分别达到平衡时放出的热量为Q1
KJ和Q2KJ,则下列比较正确的是( C )
A.Q2= 1/2 Q1=98.5 B.Q2=1/2 Q1<98.5
C.Q2<1/2 Q1<98.5 D.1/2 Q1< Q2 <98.5
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com