
题目列表(包括答案和解析)
23.(1)PCl3
(2) P(s)+Cl2(g)=== PCl3(g);△H=-306kJ·mol-1 (3分)
(3) PCl5(g)===PCl3(g)+Cl2(g);△H=+93kJ·mol-1 (3分)
(4)PCl5+4H2O===H3PO4+5HCl。
本资料由《七彩教育网》 提供!
23.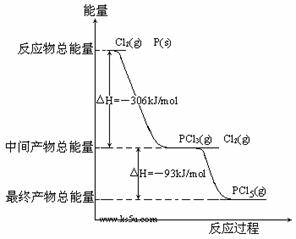 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。
根据右图回答下列问题:
(1)原子最外层电子均达到8电子结构的分子是
(选填“PCl3”或“PCl5”)。
(2)P和Cl2反应生成PCl3的热化学方程式
______ _。
(3) PCl5分解成PCl3和Cl2的热化学方程式__________________ _ 。
(4)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是
________________ ___ __。
22.(共9分)(1)确保硫酸被完全中和 (2)C (3)D (4)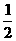 H2SO4(aq)+NaOH(aq)=
H2SO4(aq)+NaOH(aq)=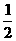 Na2SO4(aq)+ H2O(l);
△H=-56.8 kJ·mol-1 (5)碎纸条的保温性能欠佳。用棉花(或其它保温性能良好的材料)代替碎纸条(或用真空玻璃瓶代替烧杯)。
Na2SO4(aq)+ H2O(l);
△H=-56.8 kJ·mol-1 (5)碎纸条的保温性能欠佳。用棉花(或其它保温性能良好的材料)代替碎纸条(或用真空玻璃瓶代替烧杯)。
22.(9分)利用右图装置测定中和热的实验步骤如下:
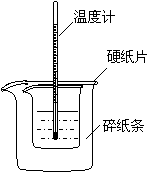 ①
用量筒量取50mL 0.25mol·L-1硫酸倒入小烧杯中,测出硫酸温度为25.0℃
①
用量筒量取50mL 0.25mol·L-1硫酸倒入小烧杯中,测出硫酸温度为25.0℃
② 用另一量筒量取50mL 0.55mol·L-1 NaOH溶液,并用另一温度计测出
其温度为25.2℃
③ 将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度
为28.5℃。
回答下列问题:
(1)为什么所用NaOH溶液要稍过量? ;
(2)倒入NaOH溶液的正确操作是 .(从下列选出)
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)使硫酸与NaOH溶液混合均匀的正确操作是 (从下列选出)
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒轻轻的搅动
(4)设溶液的的密度均为1g·cm-3,中和后溶液的比热容C=4.18 J·(g·℃)-1,请根据该反应中和热的实验值写出中和反应热化学方程式 ;
(5)上述实验中中和热的实验值往往小于理论值,其主要原因是(设操作无误)
,请提出改进措施 。
21、下列说法或表示法正确的是D
A.测定HCl和NaOH的中和热时,每次实验均应测量三个温度,即盐酸起始温度、NaOH起始温度和反应后的温度计基本稳定后的温度
B.由“C(石墨)-→C(金刚石);△H= +119 kJ/mol ”可知金刚石比石墨稳定
C.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l);△H= +571.6kJ/mol
D.在稀溶液中: H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量大于57.3kJ
20.在298K、1.01×105 Pa下,12 g石墨在24 g氧气中燃烧至反应物完全消耗,测得放出x kJ(x>0)的热量。已知在该条件下,1 mol石墨完全燃烧放出y kJ(y>0)的热量。则石墨与氧气反应生成CO的热化学方程式表达正确的是D
A、C(石墨,s)+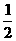 O2(g)=CO(g) △H(298K)=-y kJ·mol-1
O2(g)=CO(g) △H(298K)=-y kJ·mol-1
B、C(石墨,s)+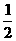 O2(g)=CO(g) △H(298K)=-x kJ·mol-1
O2(g)=CO(g) △H(298K)=-x kJ·mol-1
C、C(石墨,s)+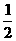 O2(g)=CO(g) △H(298K)=-(2x-y)kJ·mol-1
O2(g)=CO(g) △H(298K)=-(2x-y)kJ·mol-1
D、2C(石墨,s)+O2(g)=2CO(g) △H(298K)=-(2x-y)kJ·mol-1
19.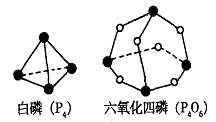 化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知白磷(P4)和P4O6的分子结构如下图所示:
化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知白磷(P4)和P4O6的分子结构如下图所示:
现提供以下化学键的键能:P-P 198KJ·mol-1、P-O 360kJ·mol-1、O=O 498kJ·mol-1。则P4+3O2=P4O6的反应热△H为 ( B)
A.+1638 kJ·mol-1 B.一1638 kJ·mol-1
C.-126 kJ·mol-1 D.+126 kJ·mol-1
18、已知31g白磷变成红磷放出18.39kJ热量,下列两反应中: C
4P(白、S)+5O2(g)=2P2O5(s),△H=Q1kJ/mol
4P(红、S)+5O2(g)=2P2O5(s),△H=Q2kJ/mol
则Q1和Q2的关系是:( )
A.Q1>Q2 B.Q1=Q2 C.Q1<Q2 D.无法确定
17. 在一定条件下化学反应:2SO2(g)+O2(g)
在一定条件下化学反应:2SO2(g)+O2(g) 2SO3(g);△H=-197kJ/mol。现有容积相同且不变的甲.乙.丙三个容器,在上述条件下分别充入的气体和达到平衡时反应放出的热量(Q)如下表所列:
2SO3(g);△H=-197kJ/mol。现有容积相同且不变的甲.乙.丙三个容器,在上述条件下分别充入的气体和达到平衡时反应放出的热量(Q)如下表所列:
|
容 器 |
SO2(mol) |
O2(mol) |
N2(mol) |
Q(kJ) |
|
甲 |
2 |
1 |
0 |
Q1 |
|
乙 |
1 |
0.5 |
0 |
Q2 |
|
丙 |
1 |
0.5 |
1 |
Q3 |
根据以上数据,下列叙述不正确的是 ( A )
A.Q1=2Q2=2Q3=197KJ
B.在上述条件下每消耗2摩SO2气体时放出的热量为197 kJ
C.在上述条件下反应生成1 molSO3气体放热98.5 kJ
D.2Q2=2Q3<Q1<197 kJ
16.盖斯定律在生产和科学研究中有很重要的意义,有些反应的反应热虽然无法直接测得,但可以利用盖斯定律间接计算求得。已知3.6 g碳在6.4 g的氧气中燃烧,至反应物耗尽,并放出X kJ热量。已知单质碳的燃烧热为Y kJ/mol,则1mol C与O2反应生成CO的反应热△H为 ( C )
A.-Y kJ/mol B.-(10X-Y) kJ/mol
C.-(5X-0.5Y) kJ/mol D.+(10X-Y) kJ/mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com